| |
|
|
UVOD
Gastrointestinalni stromalni tumor (GIST) defi-nisan je kao
mezenhimalni tumor gastrointestinalnog trakta (GIT), koji nastaje
mutacijom KIT ili PDGFRA gena speifičnom po ekspresiji proteina sa
tirozin kinaznom aktivnošću Kit CD 117. Asimptomatski oblici GIST-a,
nespecifična simptomatologija, poput osećaja nadutosti, prisustva
palpabilnih masa u abdomenu, krvarenje iz GIT-a koje može biti
akutno u vidu melena ili hematemeza ili hronično praćeno anemijom
kao manifestacijom kao i imunohistohemijske karakteristike glavne su
i definišuće odlike ove vrste tumora. Incidenca nije utvrđena za sve
populacije. Najviše podataka potiče iz industrijalizovanih zemalja.
Procenjena je godišnja incidence od 10 slučajeva na milion
stanovnika, što bi u slučaju SAD iznosilo oko 3000 novootkrivenih
slučajeva godišnje.
Pravovremena identifikacija GIST-a postala je veoma važna od
trenutka dostupnosti KIT ili PDGFRA tirozin kinaznog inhibitora -
Imatinib mesylat-a i novijih agenata ciljane onkološke terapije sada
često primenjivanih u terapiji neresektabilnih i metastatskih oblika
GIST-a. [1]
Cilj ovog prikaza slučaja je doprinos u lakšem prepoznavanju
simptoma, dijagnostici i terapiji ovako retkog oblika tumora.
PRIKAZ SLUČAJA
Pacijent, žena životne dobi 73 godine, januara 2009. javlja se
lekaru u primarnoj zdravstvenoj ustanovi zbog nadimanja u stomaku,
uglavnom postprandijalno i osećaja nelagodnosti u trbuhu, nekoliko
nedelja unazad. Navodi da je nekoliko godina unazad imala slične
tegobe koje su kraće trajale i da su verovatno bile posledica hiatus
hernije koja je dijagnostifikovana pre 15-tak godina. Fizikalni
nalaz prilikom prvog pregleda lekara nije ukaziovao na neke promene.
Krvna slika i biohemijske analize bile su u granicuama normale
(Holesterol 6,83mmol/L; Trigliceridi 2,21mmol/L; AST 17U/l; ALT
12U/l; LDH 363U/l; Alkalna fosfataza 77U/l; CRP 2,9mg/l; Glukoza 5,3
mmol/l; Urea 5,9 mmol/l; SE 10 mm/h; Le 6,2x10e9/l; Ly 2,1x10e9/l;
MID 0,2x10e9/l; Er 4,54x10e12/l; HGB 139 g/l).
Primenjena terapija H2 blokatorima i inhibitorima protonske pumpe u
trajanju od 2 nedelje nije dala rezultate. Na lični zahtev pacijenta
februara 2009. uradjen je CT abdomena. Nema podataka da li je pre
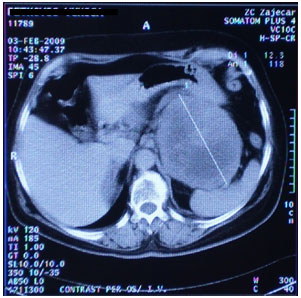
CT-a urađen ultrazvuk gornjeg abdomena. CT nalaz je pokazao da u
levom hipohondrijum između pankreasa, slezine i levog bubrega
postoji ekspanzivna formacija veličine 110mm koja posle aplikacije
kontrasnog sredstva marginalno pojačava denzitet. On nije pripadao
ni bubregu ni slezini. Radna DG radiologa je glasila: Tu abdominis
s. pseudocistis pancreaticus. (slika 1)
Slika 1. CT abdomena
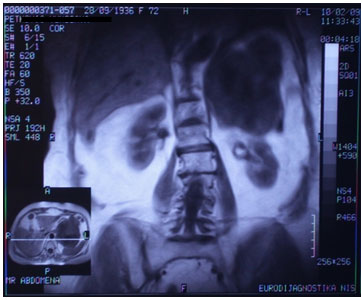
Slika 2. MRI abdomena
Pacijentkinja je upućena u višu zdravsvenu ustanovu na dalja
ispitivanja.
U višoj zdravstvenoj ustanovi urađena su dodatna ispitivanja.
Ponovni fizikalni nalaz gastroenterologa je ukazao na
paraumbilikalnu dublju rezistenciju.
Eho abdomena je pokazao da u predelu repa pankreasa prema slezini i
levom bubregu postoji inhomogena promena dimenzija 168x114x148
mm u kojoj se uočavaju transobične promene i nekroza. Zakljucak: DG
Tu Abdominis.
Na MRI snimku abdomena (načinjenom u SE sekvenci za T1W i TWu
aksijalnoj i koronarnoj ravni, nativno i nakon aplikacije
paramagnetnog kontrasnog sredstva) subfrenično levo diferencirala se
velika solidna, centralno nekrotično izmenjena tumefakcija koja je
razmicala okolne anatomske strukture, želudac put napred, rep
pankreasa put kaudalno, jasno demarkirana od perivisceralnog
prostora slezine i gornjeg pola levog bubrega. (slika 2)
Pacijentkinja je upućena na onkološki konzilijum, gde je odlučeno da
se pošalje hirurgu. Krajem februara 2009. nakon adekvatne
preoperativne pripreme pacijentkinja je operisana. Intraoperativno
je viđeno da se radi o tumoru zadnjeg zida želuca, tako da je
učinjena totalna gastrektomija sa splenektomijom i uobičajenom
rekonstrukcijom. Postoperativni tok je bio produžen zbog efuzije
leve pleure, koja je u nekoliko navrata punktirana. Inače,
digestivne funkcije su uspostavljene na vreme, drenovi su izvađeni a
konci skinuti.
Patohistološki izveštaj je pokazao da se tumor nalazio na zadnjem
delu zida korpusa na oko 20 mm od
ezofagogastričnog prelaza i na oko 210 mm od pilorusa i bio
dimenzija 130x120x110 mm. Makroskopskim pregledom preparata želuca
sa tumorom utvrđeno je da je tumor nodularne spoljašne površine koja
je najvećim svojim delom bila prekrivena intaktnom serozom koja je
nedostajala u zoni promera 40x35 mm. Na presecima, tumor je bio
srednje čvrste konzistencije, sliveno nodularne građe,
sivo-beličaste boje sa poljima krvarenja, mukoidne degeneracije i
nekrozom koja je zahvatala do 30% površine, kao i jednim većim
pseudocističnim razmekšanjem promera 80x45x40 mm. Na presecima tumor
je infiltrisao sve slojeve želuca i potiskivao mukozu, koja je u
zoni od 20x7 mm bila hiperemična i erodirana, a pokazivao je
pretežno ekstramuralno širenje u subserozno tkivo. Mukoza ostalog
dela je bila intaktna, dok je u antrumu na 40 mm od pilorusa bilo
prisutno polipoidno uzdignuće prečnika 3 mm i visine 4mm. Zaključeno
je da se radi o mezenhimalnom tumoru nejasne histogeneze, zbog čega
je bilo potrebno uraditi imunohistihemijsko ispitivanje radi
utvrđivanja definitivne dijagnoze i stepena malignog potencijala.
Imunohistohemijskim ispitivanjem je utvrđeno da je reč o
mezenhimalnom tumoru vretenastih ćelija. Tumorske ćelije su bile
relativno uniformne, lako izdužene, nejasnih citoplazmatskih
granica, eozinofilne citoplazme. Postojala je difuzna citoplazmatska
imunoreaktivnost protiv c-kit/CD117 (+++), CD34 (+++), PDGFRA (+/-)
i vimentin (+++) imunoreaktivnost. Ostali markeri nisu pokazivali
imunoreaktivnost (CD57, desmin, SMA, S-100, beta-katenin). Tumor
visoke celularnosti, umerene anaplazije. Mitotskog indeksa 7/50HPF,
prognostički faktori, proliferativni Ki-67 indeks 7,5%, p16 indeks:
95%. Stepen histološkog maligniteta: visoko maligni (po Miettinen-u,
2006.), GIST visokog rizika metastaziranja (po Flecher-u 2002.).
Prema mišljenju patohistologa, pacijent je bio kandidat za terapiju
imatinib mezilatom u eventualnom inoperabilnom stadijumu bolesti.
Na redovnim kontrolama koje su sprovodjene na svakih 3-6 meseci, u
zavisnosti od procene lekara, od aprila 2009. i koje su obuhvatale
kontrolni UZ nalaz gornjeg abdomena, CT snimak gornjeg abdomena i
toraksa i biohemijske analize, nije bilo promena odnosno znakova
recidiva i metastaziranja sve do maja 2011. U tom period od tegoba
pacijentkinja navodi povremene mučnine i kašaste stolice, što se
tumačilo kao posledica (verovatno bila) gastrektomije. Nije gubila
na težini. U maju 2011., 26 meseci nakon potpune resekcije primarnog
GIST-a, na kontrolnom CT snimku uočavaju se promene u vidu
sekundarnih depozita u jetri, nakon čega se pacijentkinja upućuje na
onkološki konzilijum gde je doneta odluka o daljem lečenju.
DISKUSIJA
GIST eksprimira na površinu svojih ćelija transmembranski
receptor KIT u 95% slucajeva a u 5% eksprimira PDFGRA
(platelet-derived growth factor receptor alpha) koji imaju tirozin
kinaznu aktivnost i produkti su KIT, odnosno PDGFRA protoonkogena
čije mutacije dovode do nekontrolisane ćelijske proliferacije i
rezistencije na apoptozu. [2,3] To su ujedno i najkarakterističnija
odlika GISTA (ekspresija mutiranih receptora za tirozin kinozni
faktor rasta). U našem slučaju postojala je pozitivnost na prisustvo
oba receptora. Imunoreaktivnost, za KIT pre svega, razlikuje GIST od
pravih leomijoma, leoimiosarkoma, švanoma i neurofibroma. Ekspresija
KIT-a, nekoliko autora je dovela do postulata da GIST potiče od
primitivne stem ćelije, koja fenotipski liči na prirodno
KIT-pozitivne Cajal-ove ćelije GIT-a. Pored KIT imunoreaktivnosti,
koja je veoma važan dijagnostički parametar, ligand-nezavisna
konstitutivna aktivacija KIT-a je takođe veoma važna u histogenezi
GIST-a. [4,5] Gist, dakle, deli fenotipsku sličnost sa Cajal-ovim
ćelijama GIT-a, koje su raspoređene oko mienteričkog pleksusa. Ove
ćelije se identifikuju kao KIT-zavisne i KIT-pozitivne ćelije koje
posreduju između nervnog i mišićnog sistema GIT-a. Njihova funkcija
uključuje pace-maker-sku aktivnost i inhibiciju neurotransmitera.
[6,7] Kao i u našem slučaju, oko 70-80% GIST-ova je pozitivno za
CD34, hematopoetski progenitor ćelijski antigen koji eksprimiraju
takođe i endotelne ćelije subfrakcija fibroblasta i druge neoplazme
povezane sa ovim ćelijskim tipovima. Velike serije su pokazale da je
30% pozitivno na glatko mišićni aktin koji je na neki način
recipročan sa CD34, tj. postoje mesta tumora koja su aktin-pozitivna
i CD34-negativna, i obrnuto. Aktinska pozitivnost (prisutnost)
varira od fokalne do proširene. U 3% slučajeva gastrični GIST je
pozitivan i na desmin, mišićni tip povezujućeg filamentskog
proteinkoji nije otkriven u našem slučaju i koji je češće prisutnij
u ezofagealnim tumorima. [4]
U zavisnosti od mesta nastanka zavisi i simptomatologija samog
GIST-a. Najčešća manifestacija simptomatskog oblika GISTa je
krvarenje iz ulcerisanog samog tumora. Pacijenti mogu imati
hematemezu, melenu, hematoheziju ili znake anemije kao posledice
okultnog krvarenja. Tu još mogu biti prisutni mučnina, povraćanje,
abdominalni bol, osećaj nadutosti, opstrukcija creva i gubitak
težine. Asimptomatski oblici, koji ne ulceriraju mogu dosta porasti
i formirati abdominalne palpabilne mase bez ispoljavanja drugih
znakova i uglavnom bivaju otkriveni slučajno tokom radioloških
ispitivanja ili drugih hirurških procedura. Naš prikaz slučaja je
oligo simptomatski oblik tumora, sa krajnje nespecifičnim
manifestacijama poput osećaja nadustosti i prisustva palpabilne
abdominalne mase. [8]
Incidenca se ne može precizno utvrditi. Podaci koji postoje, važe za
belu rasu i potiču uglavnom iz industrijalizovanih zemalja poput
Islanda, Holandije, Španije i Švedske, gde se incidenca kretala od
6,5 do 14,5 slučajeva na milion stanovnika. Pretpostavlja se da je
veća bar nekoliko puta s obzirom na postojanje asimptomatskih oblika
koji se slučajno otkrivaju intraoperativno ili tokom nekih
radioloških ispitivanja. Na osnovu velikih kliničko-patoloških
studija utvđeno je da se najučestalije javljaju između 55. i 65.
godine života. Pojava pre 40 godine je znatno ređa. Takođe, nije
utvrđena razlika u odnosu na pol [8] GIST zahvata GIT od donjeg
ezofagusa pa sve do rektuma. Najčeće zahvata želudac (60-70%), zatim
tanko crevo (25-30%) pa rectum (5%). Svega nekoliko slučajeva
zahvatanja ezofagusa i apendixa je opisano. [8]
Opisani su i primarni oblici izvan GIT-a pre svega u omentumu,
mezenterijumu i retroperitoneumu. Mada se na ovim mestima najčešće
sreće u metastatskom obliku. [9,10] Hematogene metastaze najčešće
daje u jetri, ređe u kostima i plućima. Srednje vreme preživljavanja
pacijenata sa metastatskim oblikom GISTa je 20 meseci, a sa lokalnim
recidivima je 9 do 12 meseci. [11,12]
Gist može biti i deo tumorskih sindroma kao što su familijarni oblik
GIST-a, Karnijeva trijada i neurofibromatoza. [8]
Preoperativna radioloska ispitivanja CT i MRI veoma su korisna u
determinisanju tumorske konfiguracije, proširenosti i odnosa sa
susednim organima. Generalno, učestaliji su ispupčeni u odnosu na
intaluminalne tumore, i samo mali GIST-ovi se mogu naći kao
intraluminalni tumori, a još ređe u vidu polipa. [13] Tumori malih i
srednjih dimenzija formiraju dobro ograničene sverične ili
hemisverične mase ispod mukoze gurajući je u lumen i formirajući
glatko uzvišenje. U crevima, veliki gistomi formiraju tipične
ispupčene mase. Neki gistomi želuca i creva formiraju sverične ili
hemisverične serozne nodule povezane sa zidom širokom osnovom ili
samo tankom peteljkom. Veliki gistomi želuca i creva često formiraju
spoljašne ispupčene mase čija sama veličina otežava
dijagnostifikovanje prilikom utvrđivanja porekla tumora na CT ili
MRI snimku. Na preoperativnim CT i MRI snimcima u našem slučaju nije
se moglo utvrditi poreklo tumora, odnosno pripadnost organu zbog
veličine i međusonog odnosa sa susednim organima. Tek
intraoperativno je utvrđeno poreklo tumora. Ovi tumori su uglavnom
centralno nekrotični i cistični i sadrže nekrotično-hemoragijski
material i tečnost. [13]
U najvećem broju slučajeva, kliničko ponašanje GIST-a može biti
predviđeno sa relativnom preciznošću baziranom na kombinaciji
tumorske veličine i mitotske aktivnosti iako neki mali tumori (<5cm)
i male mitotske aktivnosti (<5 mitotes per 50HPF) takođe
metastaziraju. Promene u broju DNK kopija može biti pomoćni
parametar u evaluaciji GISTa gde nezavisna vrednost ki67 analoga ne
može biti prediktor. (Tabela 1) [14]
Tabela 1. Veličina tumora i mitotski indeks kao vodiči u proceni
malignosti GIST-a*
| |
Verovatno benigni tumori
|
Verovatno maligni tumori
|
Tumori niskog malignog
potencijala |
| |
Intestinalni tumor |
Gastrični tumor |
Intestinalni tumor |
Gastrični tumor |
Intestinalni tumor |
Gastrični tumor |
| Dijametar tumora (cm) |
≤2 |
≤5 |
>5 |
>10 |
>2 i ≤5 |
>5 i ≤10 |
| Mitotski indeks (HPFs)** |
<5/50 |
<5/50 |
>5/50 |
>5/50 |
<5/50 |
<5/50 |
*Na osnovu podataka iz Miettinen i sar14; **HPFs – high-power
Hirurgija je glavni oslonac terapije za pacijente sa primarnim
GIST-om bez dokaza prisustva metastaza i
predstavlja inicijalnu terapiju ukoliko je tumor tehnički
resektabilan. Pošto je GIST retko oboljenje, ne može se uzeti u
razmatranje u diferencijalnoj dijagnozi kod palpabilnih abdominalnih
masa. Tako patološka dijagnoza ne može biti poznata pre, pa čak i za
vreme, operacije. Preoperativna biopsija je moguća ali nosi određen
rizik da, ukoliko je reč o fragilnim ili mekim oblicima GIST-a, može
doći do rupture, hemoragije i diseminacije tumora. Zbog toga,
postoperativna patološka procena je esencijalna u potvrđivanju
dijagnoze nakon potpune resekcije. [16]
Vreme od resekcije do pojave metastaza ili recidiva je otprilike 2
godine, mada je pravi recidiv namesto
prethodnog tumora izuzetno redak. [15,16]
Terapija GISTa od trenutka otkrivanja imatinib mesylata značajno se
promenila. Studije su pokazale da citotoksicna terapija pre
otkrivanja imatinib mesylata nije imala značajnijeg uspeha u lečenju
GISTa. Uspešnost je bila svega 0-27%. [17,18] zbog čega je postojala
jedinstvena saglasnost da ne treba primenjivati hemioterapiju kod
pacijenata sa GISTom.
Imatinib mesylat je selektivni, potentni, mali molekularni inhibitor
tirozin kinaznog signalizirajućeg enzima, kao što su KIT, PDFGRA i
leukemija-specifičnog BCR-ABL himera. U laboratorijskim
ispitivanjima utvrđeno je da imatinib blokira prolix-feraciju
leukemičnih ćelija koje eksprimiraju BCR-ABL i ćelija GIST-a koje
eksprimiraju KIT. [19,20]
Pošto većina pacijenata razvije recidiv ili metastaze, u nekim
zemljama kao npr. u Sjedinjenim Američkim Državama, Agencija za
hranu i lekove (Food and Drug Agency-FDA) 2008. godine odobrila je
postoperativnu primenu imatiniba za pacijente sa KIT pozitivnim
GIST-om. Optimalno vreme trajanja tretmana još uvek nije
ustanovljeno. [16] U našoj zemlji terapija imatinibom je predvidjena
samo za pacijente sa neresktabilnim i metastatskim oblikom bolesti.
Pacijentom sa suspektnim GIST-om trebalo bi da rukovodi
multidisciplinarni tim sa dobrim poznavanjem
sarkoma i tumora GI trakta. Nespecifičnost simptoma i mala incidenca
svakako u prvom trenutku ne mogu da uzmu u razmatranje ovu vrstu
tumora kao potencijalnu dijagnozu, ali adekvatno uzimanje anamneze,
detaljno obavljen fizikalni pregled i dodatne dijagnostičke
procedure u cilju postavljanja što tačnije dijagnoze i mogu
doprineti pravovremenom otkrivanju ovako retkih oblika tumora i
preduzimanju određenih terapijskih protokola.
LITERATURA
- Miettinen M, Lasota J. Gastrointestinal stromal tumors:
Review on morphology, molecular pathology, prognosis, and
differential diagnosis. Arch Pathol Lab Med 2006; 130:1466–1478.
- Lux ML, Rubin BP, Biase TL, Chen CJ, Maclure T, Demetri G et
al. KIT extracellular and kinase domain mutations in
gastrointestinal stromal tumors. Am J Pathol 2000; 156:791–795.
- Rubin BP, Singer S, Tsao C et al. KIT activation is a
ubiquitous feature of gastrointestinal stromal tumors. Cancer
Res 2001; 61:8118-8121.
- Miettinen M, Sobin LH, Sarlomo-Rikala M. Immunohistochemical
spectrum of GISTs at different sites and their differential
diagnosis with a reference to CD117 (KIT) Mod Pathol 2000;
13:1134–1142.
- Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM.
Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal
stromal tumors show phenotypic characteristics of the
interstitial cells of Cajal. Am J Pathol 1998; 152:1259–69.
- Maeda H, Yamagata A, Nishikawa S, Yoshinaga K, Kobayashi S
et al. Rrequirement of c-kit for development of intestinal
pacemaker system. Development. 1992; 116:369–375.
- Robinson TL, Sircar K, Hewlett BR, Chorneyko K, Riddell RH,
Huizinga JD. Gastrointestinal stromal tumors may originate from
a subset of CD34-positive interstitial cells of Cajal. Am J
Pathol 2000; 156:1157–1163.
- Miettinen M, Lasota J. Gastrointestinal stromal tumors
(GISTs): definition, occurrence, pathology, differential
diagnosis and molecular genetics. Pol J Pathol 2003; 54:3–24.
- Todoroki T, Sano T, Sakurai S et al. Primary omental
gastrointestinal stromal tumor (GIST). World J Surg Oncol 2007;
5; 66.
- Reith JD, Goldblum GR, Lyles RH, Weiss SW.
Extragastrointestinal (soft tissue) stromal tumors: an analysis
of 48 cases with emphasis on histologic predictors of outcome.
Mod Pathol 2000; 13:577–585.
- DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM,
Brennan MF. Two hundred gastrointestinal stromal tumors:
recurrence patterns and prognostic factors for survival. Ann
Surg 2000; 231:51–58.
- Ng EH, Pollock RE, Munsell MF, Atkinson EN, Romsdahl MM.
Prognostic factors influencing survival in gastrointestinal
leiomyosarcomas. Implications for surgical management and
staging. Ann Surg 1992; 215:68–77.
- Levy AD, Remotti HE, Thompson WM et al. Gastrointestinal
stromal tumors: radiologic features with pathologic correlation.
Radiographics 2003; 23:283-304.
- Miettinen M, el-Rifai W, Sobin L, et al: Evaluation of
malignancy and prognosis of gastrointestinal stromal tumors: A
review. Hum Pathol 2002; 33:478-483.
- Demetri GD, von Mehren M, Blanke CD et al. Efficacy and
safety of imatinib mesylate in advanced gastrointestinal stromal
tumors. N Engl J Med 2002; 347:472-480.
- Demetri GD, von Mehren M, Antonescu CR et al. NCCN Task
Force report: update on the management of patients with
gastrointestinal stromal tumors. J Natl Compr Canc Netw 2010: 8
suppl 2:S1-S41.
- Ryan DP, Puchalski T, Supko JG et al. A phase II and
pharmacokinetic study of ecteinascidin 743 in patients with
gastrointestinal stromal tumors. Oncologist 2002; 7:531–538.
- Trent JC, Beach J, Burgess MA et al. A two-arm phase II
study of temozolomide in patients with advanced gastrointestinal
stromal tumors and other soft tissue sarcomas. Cancer 2003;
98:2693– 2699.
- Heinrich MC, Griffith DJ, Druker BJ et al. Inhibition of
c-kit receptor tyrosine kinase activity by STI 571, a selective
tyrosine kinase inhibitor. Blood 2000; 96:925–932.
- Buchdunger E, Cioffi CL, Law N et al. Abl protein-tyrosine
kinase inhibitor STI571 inhibits in vitro signal transduction
medi-ated by c-kit and platelet-derived growth factor receptors.
J Pharmacol Exp Ther 2000; 295:139–145.
|
|
|
|


