| |
|
|
UVOD
Sistemski eritemski lupus je sistemsko autoimunsko oboljenje koje
se odlikuje brojnim imunskim poremećajima, a klinički se može
ispoljiti promenama na koži, zgobovima, serozama, centralnom nervnom
sistemu i bubrezima [1-3]. Češće obolevaju mlade osobe ženskog pola
(odnos žene/muškarci kod odraslih iznosi 12:1), kao i pripadnici
crne rase [1-3]. Lupus nefritis je snažan prediktor lošeg ishoda
bolesnika sa sistemskim eritemskim lupusom. [4, 5]. Kod bolesnika
koji boluju od sistemskog eritemskog lupusa oštećenje bubrega se
javlja u 60% bolesnika. Kod 10-20% bolesnika sa oštećenjem bubrega
(lupusni nefritis) nastaje terminalni stadijum hronične slabosti
bubrega [4, 5]. Rano otkrivanje sistemskog eritemskog lupusa i lupus
nefritisa omogućava pravovremenu primenu odgovarajućeg lečenja u
cilju sprečavanja progresije bolesti i razvoja terminalnog stadijuma
hronične slabosti bubrega, smanjenja morbiditeta i mortaliteta i
poboljšanja kvaliteta života ovih bolesnika [1-5].
ETIOPATOGENEZA
Etiologija sistemskog eritemskog lupusa još uvek je nejasna.
Genetski faktori, ženski fenotip, imunski poremećaji, infektivni
agensi (infekcije izazvane retrovirusima) i medikamenti (hidralazin,
prokainamid) imaju značajnu ulogu u nastanku ovog oboljenja [1-5].
Glavni antigeni za autoantitela su nukleozomi (DNA-histoni), mali
nuklearni i citoplazmatski ribonukleoproteini, kao i fosfolipidi
ćelijskih membrana. Bolesnici sa lupus nefritisom uglavnom imaju
autoantitela koja se vezuju za dvolančanu DNA (dsDNA), Smithov
antigen (Sm) i komponentu komplementa C1q [1-5].
Imunokompleksi DNA-anti-DNA-antitela imaju značajnu ulogu u
patogenezi sistemskog eritemskog lupusa i lupus nefritisa [1-4].
Pored cirkulišućih kompleksa DNA-anti-DNA antitela, u lupus
nefritisu, stvaraju se i kompleksi in situ. Histoni se vezuju za
strukture glomerula i podstiču lokalno stvaranje imunokompleksa
[1-5]. Pored autoantitela u patogenezi lupus nefrtiisa značajnu
ulogu imaju B i T ćelije [6].
KLINIČKA SLIKA
Sistemski eritemski lupus se klinički može ispoljiti promenama na
koži, zglobovima, serozama, centralnom nervnom sistemu i bubrezima.
Bolest bubrega se manifestuje proteinurijom, mikroskopskom
hematurijom, prisustvom eritrocitnih cilindara u sedimentu urina,
povećanom koncentracijom kreatinina u serumu i smanjenim klirensom
endogenog kreatinina [1-6]. Prisustvo proteina u urinu je glavni
laboratorisjski pokazatelj zahvaćenosti bubrega u sistemskom
eritemskom lupusu. Proteinurija nije samo pokazatelj oštećenja
bubrega, ona dovodi do oštećenja tubulointersticijuma i progresije
hronične slabosti bubrega [6-8].
Mikrohematurija je često prisutna, a smanjenje jačine glomerulske
filtracije se uglavnom javlja kod bolesnika sa akutnom bubrežnom
insuficijencijom. Hiperkaliemijska renalna tubulska acidoza može
biti manifestacija lupus nefritisa [6-8].
DIJAGNOSTIKA
Laboratorijska ispitivanja kod bolesnika koji boluju od sistemskog
eritemskog lupusa
Kod svakog bolesnika kod koga se dokaže proteinurija treba odrediti
i antinuklearna antitela-ANA, shema 1. Bolesnici koji boluju od
sistemskog eritemskog lupusa i imaju pozitivna anti-dsDNA-antitela
razvijaju klinički značajan lupus nefritis [1-3].
Anti-dsDNA-antitela imaju visoku dijagnostičku specifičnost,
prisutna su u gotovo 90% bolesnika sa lupusom i nefritisom i ukazuju
na aktivnost bolesti [1-3]. Anti-Sm-antitela su visoko specifična za
nefritis, ali su prisutna samo u 15-50% bolesnika sa nefritisom
[1-3]. Nefritis je opisan i kod jednog malog broja bolesnika sa
mešovitom bolešću vezivnog tkiva-MCTD (mixed connective tissue
disease), pa zato pored ANA treba odrediti i anti-RNP-antitela. Ova
antitela u odsustvu anti-dsDNA antitela ukazuju na MCTD, shema 1
[1-3]. Visok titar Anti-dsDNA-At, Anti-Sm-At i Anti-C1q-At sa
velikom senzitivnošću i specifičnošću ukazuje na razvoj lupus
nefritisa kod bolesnika sa sistemskim eritemskim lupusom [1-3].
Dijagnoza sistemskog eritemskog lupusa se po-stavlja na osnovu
kriterijuma ACR (American College of Rheumatology), tabela 2. Za
dijagnozu sistemskog eritemskog lupusa neophodno je prisustvo bar
četiri od jedanaest kriterijuma [1-5].
Ovi kriterijumi ne omogućavaju procenu aktivnosti bolesti. Za
procenu aktivnosti bolesti koriste se klinički kriterijumi
(artritis, anti-dsDNA-at, leukopenija, hipokomplementemija, ospa,
oralne ulceracije, alopecija, konvulzije, psihoza, glavobolje,
vaskulitis - ulceracije kože ili prstiju, mikrohematiruja) [2,6].
Biopsija bubrega kod bolesnika sa sistemskim eritemskim lupusom
Bolesnici sa sistemskim eritemskim lupusom sa normalnim nalazom
urina i normalnom funkcijom bubrega ne zahtevaju biopsiju bubrega.
Indikacije za biopsiju bubrega kod bolesnika sa sistemskim
eritemskim lupusom uključuju proteinuriju [novonastala proteinurija,
povećanje proteinurije (proteinurija>1,0 g/24h), teška
proteinurija], hematuriju, ćelijske cilindre u sedimentu urina,
poremećaj funkcije bubrega (akutna bubrežna insuficijencija,
brzo-progresivno opadanje funkcije bubrega), nizak nivo C3
komponente komplementa, kao i potreba za promenom terapije
(neadekvatan odgovor na primenjenu terapiju ili relaps posle
terapije) [9-11]. Patohistološke promene tkiva bu-brega bolesnika sa
lupus nefritisom, dobijenog biopsijom bubrega, sastoje se od spektra
glome-rulskih, vaskularnih i tubulointersticijumskih
promena [9-12]. Prema preporukama ISN/RPS 2003 – (International
Society of Nephrology/Renal Pathology Society 2003) u zavisnosti od
patohistološkog nalaza razlikujemo šest klasa lupus nefritis, tabela
2 [6, 9-12]. Na osnovu pato- histološkog nalaza procenjuje se i
stepen aktivnosti lupus nefritisa, tabela 3 [6, 9-12].
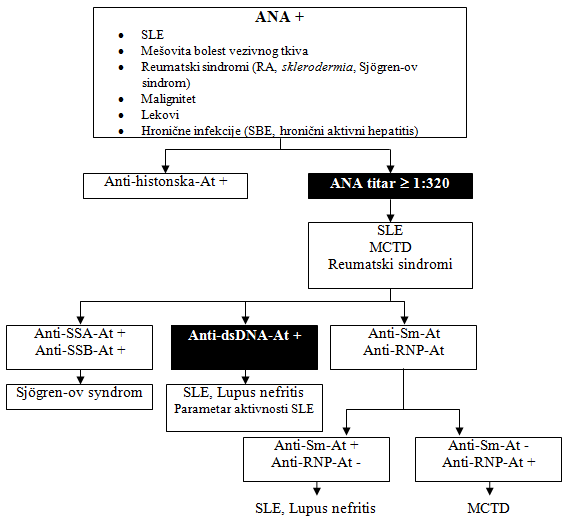
Shema 1. Dijagnostički značaj ANA
Modifikovano prema referenci [1].
Legenda: SLE - sistemski eritemsli lupus; ANA - antinuklearna
antitela; MCTD(Mixed Connective Tissue Disease) - mešovita bolest
vezivnog tkiva; SBE - subakutni bakterijski endokarditis;
LEČENJE
Lečenje imunosupresivnom terapijom
Pri izboru lečenja bolesnika sa sistemskim eritemskim lupusom i
lupus nefritisom neophodno je voditi računa o aktivnosti sistemskog
eritemskog lupusa, tipu i aktivnosti lupus nefritisa i funkciji
bubrega, tabela 4 [2,6,13,14].
Lečenje lupus nefritisa sprovodi se u dve faze: fazu indukcije
(induction treatment) i fazu održavanja (maintenance treatment),
shema 2 [2,6,13,14]. Akutna faza, faza indukcije traje 6 do 12
meseci, a sastoji se u primeni kortikosteroida.
Konvencionalna terapija sa visokim dozama kortikosteroida za per os
primenu (Pronizon per os 1,0 mg/kg/dan) praćena je razvojem
neželjenih dejstava kortikosteroida. Zbog toga se primenjuju pulsne
doze kortikosteroida - metilprednizolon u vidu intravenskih pulseva
[Metilprednizolon 500-1000 mg + 0,9%NaCl sol. 500 ccm i.v. infuzija,
tri dana uzastopno ili svaki drugi dan (3 doze), a zatim nastaviti
sa 10-20 mg pronizona per os dnevno (0,5 mg/kg/dan)] [2,6,13,14].
Difuzni proliferativni lupus nefritis i teški oblici fokalnog
proliferativnog lupus nefritisa predstavljaju najteže oblike i
zahtevaju agresivno lečenje, posebno ako su praćeni kliničkom slikom
nefritičkog ili nefrotskog sindroma i smanjenjem funkcije bubrega.
Pored kortikosteroida većina lekara se u lečenju akutne forme teškog
sistemskog eritemskog lupusa odlučuje i za primenu citotoksičnih
agenasa (imunosupresivna terapija), kao što su ciklofosfamid ili
azatioprin [2,6,13,14].
Intravenska primena ciklofosfamida u dozama od 500-1000 mg/m2
telesne površine jednom mesečno, u toku šest meseci, a zatim jednom
u tri meseca u toku dve godine, pokazala se efikasnijom i praćena je
manjim neželjenim komplikacijama u odnosu na per os primenu
ciklofosfamida u dozi 2,0-3,0 mg/kg/dan, u zavisnosti od bubrežne
funkcije (hemoragijski cistitis) [2,6,13,14].
| R.br. |
Kriterijum |
Opis |
| 1. |
Serozitis |
Pleuritis ili perikarditis |
| 2. |
Ulceracije u usnoj duplji |
Ulceracije u usnoj duplji ili nazofaringealne ulceracije
|
| 3. |
Artritis |
Neerozivni artritis dva ili više periferna zgloba |
| 4. |
Fotosenzitivnost |
Kožni osip izazvan ili pogoršan sunčevom svetlošću |
| 5. |
Hematološki poremećaji |
Hemolitička anemija ili leukopenija (<4000/µl),
limfopenija (< 1500/µl), ili trombocitopenija (< 100.000/µl)
|
| 6. |
Bubrežni poremećaji |
Perzistentna proteinurija (> 0.5 g/24h), ćelijski
cilindri
(eritrocitni, leukocitni) |
| 7. |
Antinuklearna antitela-ANA |
Povećan titar u odsustvu primene lekova koji mogu
izazvati sindrom lupusa |
| 8. |
Imunološki poremećaji |
Anti-Sm-At, Anti-dsDNA-At, Anti-fosfolipidna-At, lažno
pozitivni serološki testovi za sifilis |
| 9. |
Neurološki poremećaji |
Konvulzije (bez poznatih drugih uzroka), psihoza
(u odsustvu drugih uzroka) |
| 10. |
Osip na jagodicama lica |
Eritem (ravan ili uzdignut preko jagodičnog uzvišenja,
obično ne preko nazolabijalnih predela) |
| 11. |
Diskoidni osip |
Eritematozne izdignute mrlje sa rožastim perutanjem i
pojavom
atrofije kože |
Tabela 1. Dijagnostički kriterijumi za SLE/Kriterijumi ACR
(American College of Rheumatology) - revidirani
1997.god.Modifikovano prema referenci 2.
Hronična faza, faza održavanja, sastoji se u primeni malih doza
kortikosteroida (0,05-0,20 mg/kg/dan) i imunosupresivnih lekova u
vremenskom periodu od 2 do 4 godine. Pronizon per os 5-15 mg/dan ili
svaki drugi dan i pulsne doze ciklofosfamida: 500 mg/m2
jednom u tri meseca u toku dve godine.
Umesto ciklofosfamida može se primeniti azatioprin (Asathyoprine) u
dozi od 2,0-2,5 mg/kg/dan, per os (maksimum 150 to 200 mg/dan).
Azatioprin ima mali onkogeni potencijal, a pankreatitis i
hepatotksičnost se retko javljaju. Neki lekari smatraju da u fazi
održavanja treba primeniti ciklofosfamid per os, u dozi od 1,0-3,0
mg/kg/dan (u zavisnosti od bubrežne funkcije), u toku 12 nedelja, a
zatim lečenje nastaviti sa azatioprinom [2,6,13,14]. Kod bolesnika
kod kojih postoji rezistencija na primenjenu terapiju treba
primeniti ciklosporin, u fazi održavanja, u dozi od 3,0-5,0
mg/kg/dan (u zavisnosti od stepena bubrežne funkcije) u kombinaciji
sa malim dozama kortikosteroida (5-15 mg/dan) [2,6,13,14].
| Klasa |
Patohistološki nalaz |
| I |
Minimalni mezangijumski LN |
| II |
Mezangijumski proliferativni LN |
| III |
Fokalni proliferativni LN (< 50% od svih glomerula) |
| IV |
Difuzni proliferativni LN (> 50% od svih glomerula) |
| V |
Membranozni LN |
| VI |
Odmakli sklerozirajući LN |
Tabela 2. ISN/RPS (International Society of Nephrology/Renal
Pathology Society) klasifikacija lupus nefritisa
| R. br. |
Aktivnost lupus nefritisa |
| Indeks aktivnosti (0-24) |
| 1. |
Endokapilarna hipercelularnost glomerula |
| 2. |
Infiltracija leukocitima |
| 3. |
Subendotelni hijalini depoziti |
| 4. |
Ćelijski polumeseci |
| 5. |
Intersticijumska infiltracija |
| Indeks hroničnosti (0-12) |
| 1. |
Skleroza glomerula |
| 2. |
Fibrozni polumeseci |
| 3. |
Atrofija tubula |
| 4. |
Fibroza intersticijuma |
Tabela 3. Indeksi aktivnosti lupus nefritisa
Modifikovano prema referenci [6].
NIH skor za procenu indeksa aktivnosti i hroniciteta: svaki
parametar se gradira skalom od 0-3, najteže lezije se umnože 2 puta.
Ukupan zbir bodova za indeks aktivnosti iznosi 0-24, a za indeks
hroniciteta skor je u rasponu od 0-12.
| Težina LN |
Definicija |
| Blaga bolest |
Fokalni proliferativni glomerulonefritis (klasa III),
bez nepovoljnih histoloških karakteristika, kao što su
polumeseci, fibrinoidna nekroza ili visok hronicitet (indeks
hroniciteta > 3) ili nepovoljne kliničke karakteristike
(poremećaj funkcije bubrega, proteinurija > 3 g/24h) |
| Umereno teška bolest |
Umerena bolest se definiše kao parcijalni ili odsustvo
odgovora posle početne indukcione terapije ili odložena
remisija (> 6 meseci), ili
Fokalni proliferativni glomerulonefritis sa nepovoljnim
histološkim karakteristikama ili povećanje koncentracije
kreatinina u serumu za najmanje 30%, ili
Difuzni proliferativni nefritis (klasa IV) bez nepovoljnih
histoloških karakteristika |
| Teška bolest |
Umerena bolest definisana kao odsustvo ostvarivanja
remisije posle 6 meseci od primene indukcione terapije, ili
Proliferativna bolest (fokalni ili difuzni LN) sa oštećenom
funkcijom bubrega i fibrinoidnom nekrozom ili prisustvom
plumeseca u > 25% glomerula, ili
Mešoviti membranozni i proliferativni nefritis, ili
Proliferativni nefritis sa visokim indeksom hroniciteta sam
ili u kombinaciji sa visokim indeksom aktivnosti (indeks
hroniciteta > 4 ili indeks hroniciteta > 3 i indeks
aktivnosti > 10), ili
Brzo progresivni glomerulonefritis (dvostruki porast
koncentracije kreatinina u serumu za vremenski period od 2-3
meseca) |
Tabela 4. Definicija blagog, umereno-teškog i teškog
proliferativnog lupus nefritisa
Modifikovano prema referenci [14].
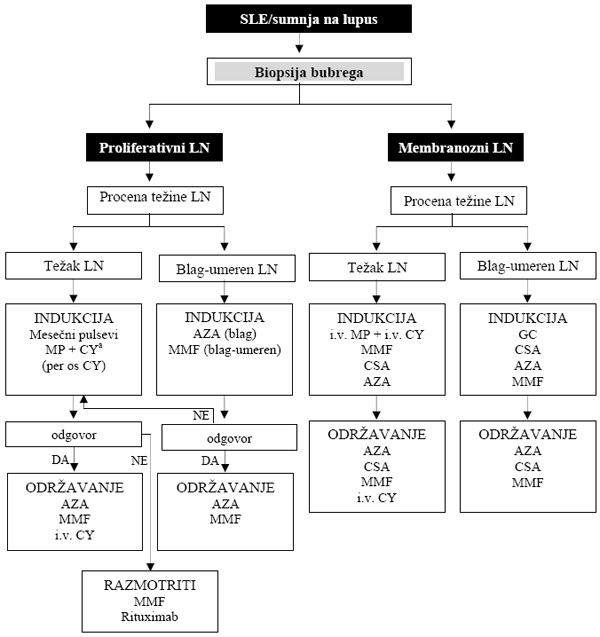
Shema 2. Algoritam za lečenje lupus nefritisa
Modifikovano prema referenci [14].
Preporučena doza kortikosteroida: 0.5-0.6 mgkg/dan u prve 4 nedelje
indukcije (1.0 mg/kg/dan kod bolesnika sa teškim renalnim i
ekstrarenalnim manifestacijama bolesti) i 0.25 mg/kg svaki drugi dan
za održavanje remisije. aNIH režim: mesečni pulsevi intravenskog
ciklofosfamida (7 x 0.5-1.0 g/m2) za bolesnike sa teškim
LN (visoko-rizični bolesnici. African American patients, oštećena
funkcija bubrega, histološke karakteristike odmaklog oštećenja,
indeks hroniciteta > 3), i EuroLupus režim (dvonedeljni pulsevi
intravenskog ciklofosfamida: 6 x 500 mg/m2), za bolesnike
sa niskim i umerenim rizikom.
Legenda: AZA - azatioprin, GC - kortikosteroidi, MP -
metilprednisolon, CSA - ciklosporin A, CY - ciklofosfa-mid, MMF -
mikofenolat mofetil.
Nova terapija uključuje primenu mikofenolat mofetila - MMF.
Mikofenolat mofetil se može koristiti za terapiju indukcije i
terapiju održavanja bolesnika sa lupus nefritisom [14-18]. U fazi
indukcije/remisije lupusnog nefritisa MMF se primenjuje u dozi od
1,0-3,0 g/dan u toku šest meseci. Indukciona terapija sa MMF je
efikasnija u odnosu na intravensku i per os primenu ciklofosfamida
[14-20].
U fazi održavanja MMF se primenjuje u dozi od 1,0-3,0 g/dan. Lečenje
MMF omogućava postizanje kompletne remisije kod značajno većeg broja
bolesnika u odnosu na lečenje konvencionalnom terapijom [14-20].
Kompletna remisija se definiše kao odsustvo aktivnog sedimenta
urina, proteinurija < 0,5 g/24h, normalna funkcija bubrega (normalne
vrednosti koncentracije kreatinina u serumu i klirensa endogenog
kreatinina) [21,22]. Parcijalna remisija se definiše kao smanjenje
proteinurije za više od 30% ili proteinurija manja od 2,0 g/24h, kod
bolesnika sa nefrotskim sindromom, normalan sediment urina i
stabilna funkcija bubrega [21, 22]. Relaps se definiše kao prisustvo
jednog od pratećih kriterijuma u najmanje dva određivanja: povećanje
proteinurije za više od 2,0 g/24h, aktivni sediment urina, povećanje
koncentracije kreatinina u serumu za > 30% [21,22].
U rezistentnim slučajevima primenjuju se Ritux-imab i intravenski
globulini. Rituximab je indikovan kod bolesnika kod kojih postoji
rezistencija na standardnu indukcionu terapiju i kod bolesnika
kontraindikovanih za kortikosteroidne i imunosupresivne agense.
Najčešće primenjivana doza je 375 mg/m2/nedeljno, 2-4
doze [14-22]. Intravenski imunoglobulini-IVIG indikovani su kod
bolesnika sa rezistentnom trombocitopenijom, pancitopenijom,
zahvaćenim centralnim nervnim sistemom, sekundarnim
antifosfolipidnim sindromom i nefritisom [14-20].
Cilj dugotrajnog lečenja bolesnika sa lupusom jeste supresija
bolesti sa što manjim neželjenim dejstvima primenjene terapije.
Stabilna renalna funkcija, odsustvo proteinurije i negativni
imunološki testovi su znaci uspešnog lečenja [13-20].
Pored specifičnog imunosupresivnog lečenja, bolesnici sa sistemskim
eritemskim lupusom i lupus nefritisom, zahtevaju i primenu
nespecifične terapije za prevenciju kardiovaskularnih bolesti
(ubrzana ateroskleroza, koronarna arterijska bolest) i osteoporoze.
Ova terapija treba da uključi lekove za kontrolu povišenog
arterijskog krvnog pritiska (blokatori konvertaze angiotenzina
I/blokatori receptora za angiotenzin II), kontrolu povećane
kon-centracije lipida u serumu (statini), kao i lekove za prevenciju
osteoporoze (preparate vitamina D, bifosfonate) [20,23].
Lečenje metodama za zamenu funkcije bubrega
Savremena imunosupresivna terapija značajno sprečava progresiju
lupusnog nefritisa. Međutim, i pored njene upotrebe 10-20% bolesnika
sa lupus nefritisom razvije terminalni stadijum hronične slabosti
bubrega i zaheva lečenje metodama za zamenu funkcije bubrega
(hemodijaliza, peritoneumska dijaliza, transplantacija bubrega)
[24].
Najveći problem bolesnika sa lupus nefritisom koji se leče
hemodijalizom su prisutna antifosfolipidna antitela-aPL, razvijen
antifosfolipidni sindrom-APS i tromboza vaskularnog pristupa za
hemodijalizu [24]. Upotreba imunsupresiva ima značajan uticaj na
visoku incidenciju peritonitisa i drugih infekcija (infekcija
izlaznog mesta peritoneumskog katetera) kod bolesnika sa lupus
nefritisom koji se leče peritoneumskom dijalizom - CAPD [24].
Pretransplantacioni skrining bolesnika sa lupus nefritisom treba da
uključi procenu: statusa kardiovaskularnog sistema (dipiridamol
talijum scintigrafija ili dobutamin stres ehokardiografija),
aktivnosti bolesti (sistemskog eritemskog lupusa i lupus nefritisa),
prisustva antifosfolipidnih i antilimfocitnih antitela, kao i
procenu gustine koštanog tkiva [24]. Bolesnici sa lupus nefritisom
su dobri kandidati za transplantaciju bubrega, a bolji rezultati se
postižu sa living donor transplantacijom - LDTx [24].
ZAKLJUČAK
Rano otkrivanje sistemskog eritemskog lupusa i lupus nefritisa
omogućava pravovremenu primenu odgovarajućeg lečenja, a to za
posledicu ima manji stepen progresije bolesti, manji morbiditet i
mortalitet i bolji kvalitet života ovih bolesnika.
LITERATURA
- Appel GB, Radhakrishnan J, D,Agati VD. Secondary Glomerular
Disease. In: The Kidney. Brenner BM. Ed.: 1382-98. The WB.
Saunders, Philadelphia, 2004.
- Cameron JS. Lupus nephritis. J Am Soc Nephrol 1999; 10(2):
413-24.
- Rahman A, Isenberg DA. Systemic Lupus Erythematosus. N Eng J
Med 2008; 358(9): 929-39.
- Mavragani CP, Moutsopoulos HM. Lupus nephritis: current
issues. Ann Rheum Dis 2003; 62(9): 795-8.
- Chrysochou C, Randhawa H, Reeve R, Waldek S, Wood GN.
Determinants of renal functional outcome in lupus nephritis: a
single centre retrospective study. QJM 2008; 101(4): 313-6.
- Dolff S, Berden JHM, Bijl M. Treatment of lupus nephritis.
Expert Rev Clin Immunol 2010; 6(6): 901-11.
- Stojimirović B, Petrović D. Uticaj proteinurije na oštećenje
tubulointersticijuma. Med Pregl 2003; LVI(7-8): 351-4.
- Petrović D, Stojimirović B. Proteinuria as a risk factor for
progression of chronic renal disease. Vojnosanit Pregl 2008;
65(7): 552-8.
- Chrstopher-Stine L, Siedner M, Lin J, Haas M, Parekh H,
Petri M, Fine DM. Renal Biopsy in Lupus Patients with Low Levels
of Proteinuria. J Rheumatol 2007; 34(2): 332-5.
- Weening JJ, D’Agati VD, Schwartz MM, Seshan SV, Alpers CE,
Appel GB, et al, on behalf of the International Society of
Nephrology and Renal Pathology Society Working Group on the
classification of lupus nephritis. The Classification of
Glomerulonephritis in Systemic Lupus Erythematosus Revisited. J
Am Soc Nephrol 2004; 15(2): 241-50.
- Bihl GR, Petri M, Fine DM. Kidney biopsy in lupus nephritis:
look before you leap. Nephrol Dial Transplant 2006; 21(7):
1749-52.
- Markowitz GS, D,Agati VD. The ISN/RPS 2003 classification of
lupus nephritis: An assessment at 3 years. Kidne Int 2007;
71(6): 491-5.
- Ponticelli C. New Therapies for Lupus Nephritis. Clin J Am
Soc Nephrol 2006; 1(4): 863-8.
- Bertsias G, Boumpas DT. Update on the management of lupus
nephritis: let the treatment fit the patient. Nat Clin Pract
Rheumatol 2008; 4(9): 464-72.
- Ginzler EM, Dooley AD, Aranow C, Kim MY, Buyon J, Merrill
JT, et al. Mycophenolate Mofetil or Intravenous Cyclophosphamide
for Lupus Nephritis. N Engl J Med 2005; 353(21): 2219-28.
- Contreras G, Sosnov J. Role of Mycophenolate Mofetil in the
Treatment of Lupus Nephritis. Clin J Am Soc Nephrol 2007; 2(5):
879-82.
- Walsh M, James M, Jayne D, Tonelli M, Manns BJ, Hemmelgarn
BR. Mycophenolate Mofetil for Induction Therapy of Lupus
Nephritis: A Systematic Review and Meta-Analysis. Clin J Am Soc
Nephrol 2007; 2(5): 968-75.
- Waldman M, Appel GB. Update on the treatment of lupus
nephritis. Kidney Int 2006; 70(8): 1403-12.
- Bomback AS, Appel GB. Updates on the Treatment of Lupus
Nephritis. J Am Soc Nephrol 2010; 21(12): 2028-35.
- Lee YH, Woo JH, Choi SJ, Ji JD, Song GG. Induction and
maintenance therapy for lupus nephritis: a systematic review and
meta-analysis. Lupus 2010; 19(6): 703-10.
- Ioannidis JPA, Boki KA, Katsorida ME, Drosos AA, Skopouli
FN, Boletis JN, et al. Remission, relapse, and re-remission of
proliferative lupus nephritis treated with cyclophosphamide.
Kidney Int 2000; 57(1): 258-64.
- Kapitsinou PP, Boletis JN, Skopouli FN, Boki KA,
Moutsopoulos HM. Lupus nephritis: treatment with mycofphenolate
mofetil. Rheumatology 2004; 43(3): 377-80.
- Stojimirović B, Petrović D. Klinički značaj kontrole faktora
rizika u sprečavanju progresije hronične slabosti bubrega.
Vojnosanit Pregl 2006; 63(6): 585-91.
- Rietveld A, Berden JHM. Renal replacement therapy in lupus
nephritis. Nephrol Dial Transplant 2008; 23(10): 3056-60.
|
|
|
|


