|
||||||||||||||||||||||||||||||||||||
| [ Sadržaj
] [ Indeks autora ]
|
||||||||||||||||||||||||||||||||||||
| UDK 616.71-006-033.2-089 COBISS.SR-ID 225191692 |
ISSN 0350-2899. - God. 41, br. 2 (2016), str. 107-114. |
|||||||||||||||||||||||||||||||||||
|
Originalni rad / Original paper Analiza vrednosti 14 parametara
kao prognostičkih faktora preživljavanja kod pacijenata sa
operisanim skeletnim metastazama u apendikulranom skeletu Dejan Maljković (1), Zoran Vučinić (2), Aleksandar
Đorđević (2) |
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||
| Preuzmite rad u pdf formatu | Sažetak: Skeletne
metastaze su najčešći koštani tumori kod pacijenata starijih od 40
godina. U Srbiji godišnje se otkrije preko 32 000 novih bolesnika sa
malignim tumorima, sa tendencijom rasta ovog broja svake godine.
Zbog razvoja terapija dobre efikasnosti, preživljavanje bolesnika od
malignih bolesti je sve duže, zbog čega se povećava broj skeletnih
komplikacija, od kojih je najvažnija patološki prelom, sa kojim se
ortopedi sve češće susreću. Cilj istraživanja: Utvrđivanje vrednosti
14 parametara kao prediktora preživljavanja pacijenata sa skeletnim
metastazama i određivanje najjačih prediktora preživljavanja.
Materijali i metode: Analiza 14 parametara kod 80 pacijenata
operisanih zbog skeletnih metastaza je urađena deskriptivnim i
analitičkim statističkim metodama (Kaplan-Meierova kriva
preživljavanja, Cox regresioni model proporcionalnih rizika i χ2
test). Analizirani su parametri: pol, starost pacijenta,
lokalizacija skeletne metastaze, tip primarnog tumora, preoperativni
nivo limfocita, hemoglobina i alkalne fosfataze, visceralna
metastaza, broj skeletnih metastaza, tip hirurške resekcije, bol,
patološke frakture, opšte stanje pacijenta obolelog od maligne
bolesti po Istočnoj kooperativnoj onkološkoj grupi (ECOG status) i
vrsta implantanata. Rezultati: U grupi operisanih pacijenata je bilo
46 žena i 34 muškarca (57% i 43%), od 34 do 82 godine (prosek godina
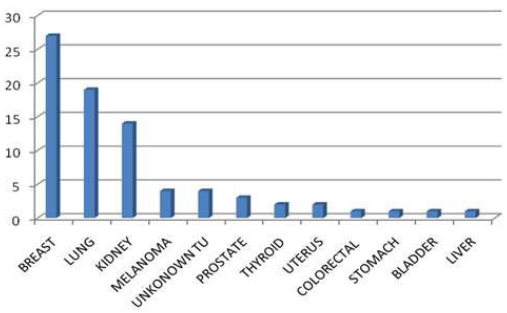
63,15). Primarni tumori su bili: dojka 27 (34%), pluća 19 (24%),
bubreg 14 (18%), melanom 4 (5%), nepoznat primarni tu. 4 (5%),
prostata 3 (4%), tireoidea 2 (3%), uterus 2 (3%), kolorektalni 1
(1%), želudac 1 (1%), mokraćna bešika 1 (1%) i jetra 1 (1%).
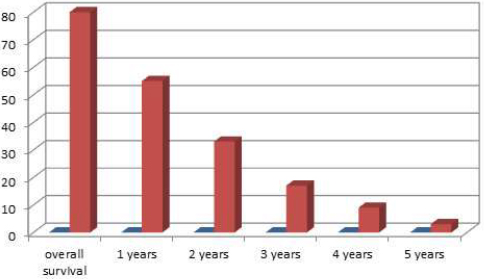
Sveukupno preživljavanje je bilo: 1 godinu – 68% , 2 godine – 41% ,
3 godine – 21%, 4 godine – 11% i preko 5 godina – 3% pacijenata. U
grupi tumora sa rapidnim rastom bilo je 33 ( 41%), a u grupi tumora
sa umerenim rastom primarnog tumora bilo je 47 (59%) pacijenata.
Pacijenata sa solitarnim skeletnim metastazama je bilo 54 (67%), a
sa multiplim 26 (33%). Broj pacijenata sa visceralnim metastazama je
bio 19 (24%), a bez visceralnih metastaza je bio 61 (76%). Prema
ECOG statusu, u trenutku operativnog lečenja sa skorom 0, 1, 2 bilo
je 44 (55%), a sa skorom 3, 4 – 36 (45%) pacijenata. Sa nivoom
hemoglobina preoperativno (do 90g/l i preko 90g/l) bila su po 40
(50%) pacijenata. Za tip primarnog tumora, visceraleih metastaza,
broj skeletnih metastaza, ECOG statusa, preoperativnog nivoa
hemoglobina i obima resekcije tumora nađeno je da su jaki i
prognostički faktori sa p<0,0001 po Kaplan-Meirovoj krivi
preživljavanja. Zaključak: Rapidno rastući tumor, prisustvo
visceralnih metastaza, prisustvo multiplih skeletnih metastaza, loš
ECOG status, preoperativni nivo hemoglobina ispod 90g/l i široka
resekcija tumora su loši prognostički faktori preživljavanja kod
bolesnika sa skeletnim metastazama. Prisustvo patološke frakture,
pol, godine života, lokalizacija skeletne metastaze, prisustvo bola,
vrsta implantata i preoperativni nivoi limfocita i alkalne fosfataze
nemaju nikakav prognostički uticaj na preživljavanje. Ključne reči: metastaze, hirurgija, preživljavanje, skor sistem, prediktori. Summary: Skeletal metastases are the most frequent bone
tumours among the patients who are more than 40 years old. In Serbia
over 32,000 new patients with malign tumours are diagnosed every
year, with the tendency to increase each year. Due to the
development of high efficacy treatments, the survival of patients
suffering from malign diseases is becoming longer, the result of
which is the increased number of skeletal complications. The most
significant skeletal complication is a pathological fracture, most
commonly observed by the orthopaedics. The objective: Determining
the values of 14 parameters as survival predictors among patients
with skeletal metastasis and determining the strongest survival
predictors. Materials and methods: The analysis of 14 parameters in
80 patients who had undergone surgery due to skeletal metastasis was
done by means of descriptive and analytical statistical methods
(Kaplan-Meier survival curve, Cox regression model of proportional
risks and χ2 test). The estimated parameters were: gender, age,
skeletal metastasis localisation, the type of primary tumour,
preoperative lymphocyte, haemoglobin and alkaline phosphates level,
visceral metastasis, the number of skeletal metastasis, the type of
surgical resection, pain, pathological fractures, general condition
of malignant patients according to the Eastern Cooperative Oncology
Group (ECOG status) and the type of implants. Results: The group of
46 patients who had undergone surgery consisted of 46 female and 34
male patients (57% and 43%) aging between 34 and 82 (the average age
- 63.15). The primary tumours were localized as: breast tumour at 27
patients (34%), lungs 19 (24%), kidney 14 (18%), melanoma 4 (5%),
the primary tumour of unknown origin 4 (5%), prostate 3 (4%),
thyroid 2 (3%), uterine 2 (3%), colorectal 1 (1%), gastric 1(1%),
bladder 1 (1%), liver 1 (1%). The total survival achieved: 1
year-68%, 2 years-41%, 3 years- 21%, 4 years- 11 %, more than 5
years-3%. 33 patients (41%) were characterised with rapid increase
tumours and 47 patients (59%) were characterised with moderate
increase of primary tumour. Solitaire skeletal metastases were
diagnosed in 54 patients (67%) and multiple metastases were
diagnosed at 26 patients (33%). The number of patients with visceral
metastasis was 19 (24%), and the visceral metastasis was not
diagnosed at 61 patients (76%). At the time of surgery, there were
44 patents (55%) with EOCG status 0,1,2 and 36 (45%) patients with
3,4 status. Preoperative haemoglobin level (less than 90g∕l and
above 90g∕l) was found in 40 patients (50%) each. The Kaplan –Meier
survival curve provided strong prognostic factors p<0.0001 for
different types of primary tumour with visceral metastasis, skeletal
metastasis, ECOG status, preoperative haemoglobin level, and the
tumour resection level. Conclusion: Rapidly growing tumour, the
presence of visceral metastasis, the multiple skeletal metastasis,
low ECOG status, low preoperative haemoglobin level (less than
90g∕l), and wide tumour resection provide low prognostic survival
factor for patients with skeletal metastasis. The presence of
pathological fracture, gender, age, skeletal metastasis
localization, pain, the type of implant and preoperative lymphocyte
and alkaline phosphatase level do not have any prognostic impact on
survival. |
|||||||||||||||||||||||||||||||||||
UVODSkeletne metastaze kod bolesnika sa poznatim ili nepoznatim
primarnim malignim tumorima su veliki ortopedski i onokološki
problem, koji dramatično pogoršavaju prognozu nekih vrsta tumora.
Skeletne metastaze su najčešći koštani tumori kod pacijenata
starijih od 40 godina [1, 2]. Posle pluća i jetre, skelet je
najučestalija lokalizacija metastatskih tumora [1, 2]. U 2005.
godini, prema podacima američke Akademije ortopedskih hirurga, umrlo
je 570 280 osoba sa razvijenim skeletnim metastazama. Prema podacima
American Cancer Society, najčešći tumori koji razvijaju metastaze u
skelet su: prostata, dojka, pluća, bubreg i štitasta žlezda [3, 4,
5, 6]. Oko 40 000 pacijentkinja svake godine umre od karcinoma dojke
u USA, a rizik od nastanka karcionoma dojke u SAD je 12,6%, odnosno
1 od 8 žena oboli od karcionoma dojke [7]. U Danskoj, u periodu od 8
godina, bilo je oko 1 500 pacijentkinja sa razvijenim skeletnim
metastazama od karcinoma dojke u populaciji od 4,5 miliona
stanovnika [5]. MATERIJALI I METODEU studiji je analizirano 80 pacijenata sa dijagnostifikovanim i
hirurški lečenim metastazama dugih cevastih kostiju na IOHB
„Banjica”, Beograd i u Opštoj bolnici Sremska Mitrovica. Studijom su
obuhvaćeni pacijenti sa metastazama u apendikularnom skeletu, bez
obzira na primarno poreklo tumora. To je studija preseka, u kojoj su
analizirani pacijenti operisani u obe ustanove u periodu 1996–2014.
godine. REZULTATIU grupi operisanih pacijenata bilo je 46 žena i 34 muškarca (57%
i 43%). Godine života u trenutku operativnog lečenja su bile od 34
do 82 godine (prosek godina 63,15).
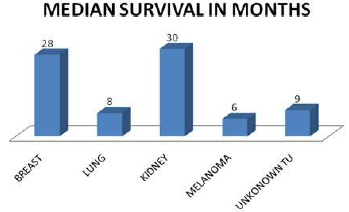
Vreme praćenja pacijenata iznosilo je 2 do 72 meseci, do smrti ili do kraja istraživanja. Sveukupno preživljavanje je bilo: 1 godinu – 68% , 2 godine – 41% , 3 godine – 21%, 4 godine – 11% i preko 5 godina – 3% pacijenata. Po tipu primarnog tumora, srednje preživljavanje najčešćih primarnih tumora je bilo: dojka – 28 meseci, bubreg – 30 meseci, nepoznati primarni tumor – 9 meseci, pluća – 8 meseci i melanom – 6 meseci.
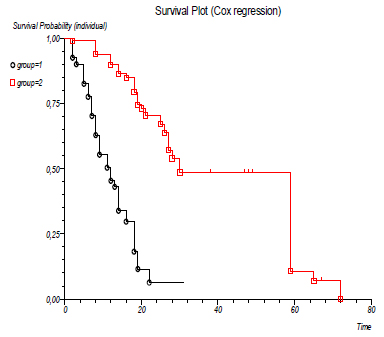
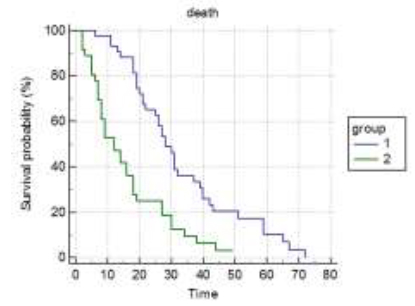
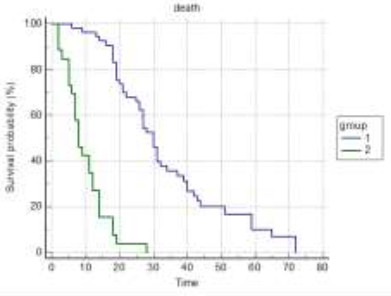
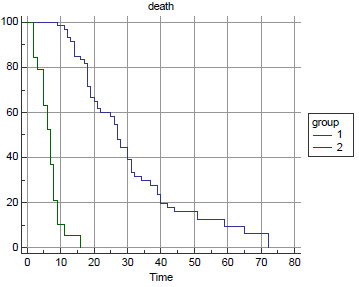
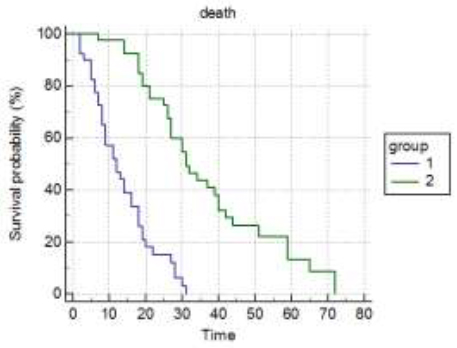
U grupi tumora sa rapidnim rastom bilo je 33 (41%), a u grupi tumora sa umerenim rastom primarnog tumora bilo je 47 (59%) pacijenata. Srednje preživljavanje je bilo 11 meseci, za grupu sa brzorastućim primarnim tumorima, a 30 meseci, za grupu sa spororastućim primarnim tumorima. Tip primarnog tumora je veoma jak prognostički faktor sa p<0,0001 po Kaplan-Meirovoj krivoj preživljavanja.
ECOG status je model koji pokazuje opšte stanje pacijenta obolelog od maligne bolesti. ECOG status u trenutku operativnog lečenja je bio: grupa 0, 1, 2 – 44 (55%) i grupa 3, 4 – 36 (45%). Srednje preživljavanje prve grupe je bilo 28 meseci, a druge grupe 12 meseci. Nađena je i značajna razlika u preživljavanju između grupa ECOG statusa, p<0,0001. ECOG status je jak prognostički faktor sa <0,0001 po Kaplan-Meirovoj krivoj preživljavanja.
Pacijenata sa solitarnim skeletnim metastazama je bilo 54 (67%), a sa multiplim 26 (33%). Srednje preživljavanje pacijenata sa solitarnim skeletnim metastazama je 30 meseci, a sa multiplim 8 meseci. Nađena je značajna razlika u preživljavanju između grupa, p<0,0001. Broj skeletnih metastaza se pokazao kao jak prognostički faktor preživljavanja sa p<0,0001 po Kaplan-Meirovoj krivoj preživljavanja.
Broj pacijenata sa visceralnim metastazama je bio 19 (24%), a bez visceralnih metastaza je bio 61 (76%). Srednje preživljavanje prve grupe pacijenata sa visceralnim metastazama je 7 meseci, a grupe bez visceralnih metastaza je 27 meseci. Prisustvo ili odsustvo visceralnih metastaza je najjači prognostički faktor preživljavanja, p<0,0001 po Kaplan-Meierovoj krivi preživljavanja.
Sa nivoom hemoglobina preoperativno (do 90g/l i preko 90g/l) bila su po 40 (50%) pacijenata. Srednje preživljavanje prve grupe je bilo 12 meseci, a druge 31 mesec. Nivo hemoglobina se pokazao kao jak parametar preživljavanja, p<0,0001 po Kaplan-Meierovoj krivi preživljavanja.
Analizirano je preživljavanje kod dve vrste ekscizije, grupa
pacijenata sa marginalnom i grupa sa širokom ekscizijom tumora.
Srednje preživljavanje je bilo u prvoj grupi 19 meseci, a u drugoj
40 meseci. P<0,0001 je po Kaplan-Meirovoj krivi preživljavanja. DISKUSIJASkeletne komplikacije metastaze su najveći faktor pogoršanja
kvaliteta života pacijenata, jer one mogu da prouzrokuju neregulisan
bol, preteći ili nastali patološki prelom, hiperkalcemiju, gubitak
funkcije ekstremiteta i često nepokretnost i vezanost za postelju
[1, 3, 4, 9, 10]. Očekivana dužina preživljavanja je glavni
parametar u odluci o hirurškoj terapiji kod ovih bolesnika [9, 10,
11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27,
28]. LITERATURA
|
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||
| Adresa autora / Corresponding
address: Dejan Maljković, Služba za ortopediju, Opšta bolnica Sremska Mitrovica, Stari šor 65, 22000 Sremska Mitrovica, Srbija. E-mail: find93@open.telekom.rs |
Rad primljen: 5.11.2015. Rad prihvaćen: 27.3.2016. Elektronska verzija objavljena: 28.3.2016. |
|||||||||||||||||||||||||||||||||||
| [ Sadržaj
] [ Indeks autora ]
|
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||