| |
|
|
UVOD
Multipli mijelom (MM) je maligno oboljenje koje se odlikuje
povećanom i nekontrolisanom prolife-racijom plazma ćelija iz jednog
klona u kostnoj srži i pojačanim stvaranjem monoklonskih
imuno-globulina ili njihovih subjedinica [1]. Predstavlja približno
10% svih hematoloških maligniteta, a je-dnogodišnja stopa
incidencije u Evropskoj Uniji iznosi 5.7/100.000 stanovnika [1,2].
Oštećenje bu-brega je prisutno u 50% bolesnika u trenutku
dijagnostikovanja MM, a akutno oštećenje bubrega, izazvano
monoklonskim lakim lancima („cast nephropathy“/mijelomski bubreg),
koje zahteva dijalizu, javlja se u 10% slučajeva [1,2]. Stopa
petogodišnjeg preživljavanja bolesnika koji boluju od MM je niska i
iznosi 28% [2].
Dijagnostikovanje i klasifikacija multiplog mijeloma
Dijagnostikovanje MM uključuje anamnezu (bolovi u kostima,
malaksalost, zamaranje, gubitak u telesnoj težini i dr.), fizikalni
pregled bolesnika (osetljivost na pritisak kostiju), standardne
labo-ratorijske analize (kompletna krvna slika, konce-ntracija
kalcijuma i kreatinina u serumu, koncen-tracija ukupnih proteina,
albumina, β2-mikroglobulina, C-reaktivnog proteina i laktat
dehidro-genaze - LDH u serumu i dr.), imunoelektroforezu proteina
seruma i urina, određivanje koncentracije monoklonskih proteina u
serumu i urinu, određi-vanje koncentracije monoklonskih slobodnih
lakih lanaca u serumu i punkciju i/ili biopsiju kostne srži
(procenat plazmocita, citogenetska ispitivanja, fluorescentna in
situ hibridizacija - FISH) [3]. Za otkrivanje polja osteolize
koštanog sistema koristi se standardna (konvencionalna) radiološka
dijagno-stika (radiografija kostiju lobanje, kičmenog stuba,
pljosnatih kostiju grudnog koša i karličnog pojasa, kao i dugih
cevastih kostiju). Kod bolesnika sa simptomima (bolovima u kostima),
a kod kojih je nalaz konvencionalne radiografije uredan prime-njuju
se dopunske dijagnostičke radiološke proce-dure, kao što su
kompjuterizovana tomografija (CT), magnetna rezonanca (MRI) ili
pozitron emisiona kompjuterizovana tomografija (PET/CT) [3,5].
Tabela 1. Dijagnostički kriterijumi za MM
Table 1. MM diagnostic criteria: all three required
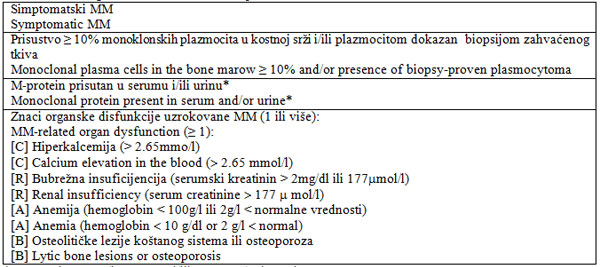
* M-protein: ≥ 10g/l u serumu i/ili ≥ 200mg/24h u
urinu
* M-protein: ≥ 10g/l in serum and/or ≥ 200mg/24h in urine
Maligne bolesti plazma ćelija predstavljaju različitu grupu
oboljenja i zahtevaju precizno definisane dijagnostičke kriterijume.
Internacionalna radna grupa za multipli mijelom (IMWG -
International Myeloma Working Group) i eksperti Mayo klinike su
precizno definisali kriterijume za dijagno-stikovanje monoklonske
gamapatije nepoznatog (neutvrđenog) značaja (MGUS), solitarnog
plazmo-citoma, multiplog mijeloma, Waldenström-ove
makroglobulinemije, asimptomatskog (indo-lentni) mijeloma, sistemske
amiloidoze i POEMS si-ndroma [6,7]. Za dijagnozu MM neophodno je
prisustvo sva tri dijagnostička kriterijuma koji su navedeni u
tabeli 1 [6,7]. Naime, MM predstavlja aktivnu, simptomatsku bolest
koja zahteva primenu terapije. Skraćenica CRAB definiše najčešće
pore-mećaje funkcije organa koje prate MM (hiper-kalcemija, bubrežna
insuficijencija, anemija, polja osteolize koštanog sistema), ali
takođe mogu biti prisutni i drugi simptomi uzrokovani bolešću
(hipe-rviskozni sindrom, ponavljane bakterijske infekcije i dr). Ako
nije moguće dokazati M-protein (nese-k-retorni MM), onda je
neophodan dijagnostički kri-terijum postojanje više od 30%
monoklonskih pla-zmocita u kostnoj srži ili plazmocitom dokazan
biopsijom zahvaćenog tkiva (bolesnici kod kojih je biopsijom dokazan
solitarni plazmocitom i koji u kostnoj srži imaju ≥30% monoklonskih
plazmocita) [6,7]. Dodatna ispitivanja uključuju utvrđivanje
stadijuma bolesti (Durie/Salmon sistem, Durie/ Salmon PLUS sistem,
International Staging System - ISS), a citogenetika i FISH
omogućavaju predviđanje ishoda bolesnika koji boluju od multiplog
mijeloma [3,4,8,9].
Oštećenje bubrega u multiplom mijelomu
Oštećenje bubrega (bubrežna insuficijencija) je jedan od glavnih
uzroka morbiditeta i mortaliteta bolesnika koji boluju od MM.
Spektar oštećenja bubrega u MM uključuje: nefropatiju izazvanu
cilindrima ili mijelomski bub-reg (cast nephropathy) (30-50%),
bolest deponovanja lakih lanaca - LCDD (10-25%) i amiloidozu bubrega
izazvanu lakim lancima - AL (10-30%) [10,11].
U fiziološkim uslovima, poliklonski slobodni laki lanci se stvaraju
u plazma ćelijama u kostnoj srži i filtriraju kroz zid kapilara
glomerula u količini od 600 mg/24h. Razlikujemo dva tipa
poliklonskih slobodnih lakih lanaca - FLC: kapa-k i lambda-λ. Kapa
laki lanci su monomeri, molekulske mase 22,5 kDa, a njihova normalna
koncentracija u serumu iznosi 3,3-19,4 mg/l. Lambda laki lanci su
pretežno dimeri, molekulske mase 45 kDa, a normalna koncentracija u
serumu iznosi 5,7-26,3 mg/l (odnos k/λ = 0,25-1,65). Poliklonski
slobodni laki lanci se filtriraju u glomerulima i gotovo u
pot-punosti reapsorbuju na nivou epitelnih ćelija proksimalnih
tubula bubrega (putem mokraće izluči se 3-5 mg/24h) [1,12].
Kod bolesnika koji boluju od MM pojačano je stvaranje monoklonskih
lakih lanaca imuno-globulina. Povećava se njihova koncentracija u
serumu, filtracija kroz zid kapilara glomerula i koncentracija u
tečnosti lumena proksimalnih tu-bula nefrona bubrega. Ispitivanja
pokazuju da monoklonski laki lanci ispoljavaju direktno citotoksično
dejstvo na epitelne ćelije proksimalnih tubula - EĆPT (vakuolizacija
citoplazme, fokalni gubitak mikrovila, apoptoza ćelija) [13-15].
Poja-čana i produžena reapsorpcija monoklonskih lakih lanaca
imunoglobulina dovodi do aktivacije nukle-arnog faktora-kB - NFkB u
EĆPT, a to za posledicu ima povećano stvaranje i oslobađanje
proza-paljenskih medijatora - interleukina-1 (IL-1), interleukina-6
(IL-6), interleukina-8 (IL-8), mono-citnog hemotaksičnog proteina-1
(MCP-1), tumor nekrotizirajućeg faktor alfa (TNFα), transfor-mišućeg
faktora rasta beta-1 (TGFβ1). Ovi me-dijatori se oslobađaju preko
bazalne membrane EĆPT u intersticijum bubrega, izazivaju zapaljenje
intersticijuma (nakupljanje monocita/makrofagnih ćelija), stimulišu
fibroblaste intersticijuma da pojačano stvaraju proteine
vanćelijskog matriksa i izazivaju ožiljavanje tubulointersticijuma
[13-16]. Monoklonski laki lanci imunoglobulina podstiču i
preoblikovanje EĆPT u miofibroblaste i na taj način dodatno
doprinose ožiljavanju tubulointe-rsticijuma [13-16].
Kada se prevaziđe maksimalni kapacitet proksi-malnih tubula da
reapsorbuju monoklonske lake lance, oni dospevaju do lumena
distalnih tubula, gde se spajaju sa Tamm-Horsfall-ovim proteinima i
grade cilindre, shema 1 [11-16]. Opstrukcija lumena distalnih tubula
dovodi do povećanja pritiska u lumenu tubula, pucanja bazalne
membrane tubula i isticanja sadržaja iz lumena tubula u
intersticijumu i razvoja intersticijumskog nefritisa [11-16]. U
fakto-re rizika koji pogoduju stvaranju cilindara spadaju: smanjenje
zapremine krvi u arterijskoj cirkulaciji (hipoperfuzija bubrega),
povećana koncentracija Na+ i Ca2+ u lumenu distalnih tubula, nizak
pH tečnosti u lumenu distalnih tubula, hiperkalcemija
(vazokonstrikcija krvnih sudova bubrega i sma-njenje jačine
glomerulske filtracije - JGF), upotreba nestereoidnih
antiinflamatornih lekova i radioko-ntrastnih sredstava [11-16].
Glavni patohistološki nalaz kod bolesnika koji boluju od mijelomskog
bubrega je prisustvo cilindara u distalnim tubulima, ruptura tubula,
akutna tubulska nekroza, infiltracija intersticijuma mononuklearnim
ćelijama, atrofija tubula i ožiljavanje tubulointersticijuma
[11-17].
Kod bolesnika koji boluju od MM, pored nefro-patije izazvane
cilindrima do oštećenja bubrega dolazi i zbog deponovanja lakih
lanaca u bubregu: bolest deponovanja lakih lanaca - LCDD (light
cha-in deposition disease) i amiloidoza bubrega izazva-na
monoklonskim lakim lancina - AL [11-18]. LCDD se javlja u 10-15%
bolesnika koji boluju od MM, češće u mlađoj populaciji bolesnika i
2.5 puta ćešće kod muškaraca u odnosu na žene [11-18]. Glavne
patohistološke karakteristike LCDD su: depoziti lakih lanaca koji se
ne boje crveno primenom boje Kongo-red, nodularna glome-ruloskleroza
koja se vidi svetlosnom mikrosko-pijom, imunofluorescentna
mikroskopija prikazuje linearne depozite duž bazalne membane
glomerula i tubula, a elektronska mikroskopija pokazuje
nefi-brilarne elektronski guste depozite u mezangijumu, bazalnoj
membrani glomerula i tubula [11-18]. Oštećenje bubrega se ispoljava
stečenim Fanco-nijevim sindromom (proksimalna renalna tubulska
acidoza tip 2 - PRTA-2), naglim i progresivnim opadanjem funkcije
bubrega, proteinurijom i mikrohematurijom [11-18].
Amiloidoza bubrega izazvana lakim lancima javlja se u 10% bolesnika
koji boluju od MM [11-19]. Amiloid se sastoji od vlaknastih proteina
(fibrila), koji su otporni na dejstvo proteaza, a njegova glavna
karakteristika je da se boji roze sa hematoksilin-eozinom, a crveno
primenom boje Kongo-red [10,11-19]. U bubrezima amiloid se nakuplja
u mezangijumu, intersticijumu i periva-skularno, a oštećenje bubrega
se u amiloidozi ispo-ljava nefrotskim sindromom (periferni otoci,
prote-inurija, hipoalbuminemija) i hroničnom bubrežnom
insuficijencijom [10,19-21].
U mehanizme oštećenja bubrega, nezavisno od monoklonskih proteina
spadaju: smanjena zapre-mina krvi u arterijskoj cirkulaciji,
toksično dejstvo medikamenata (zoledronat izaziva akutno oštećenje
bubrega) i sindrom razgradnje ćelija tumora [22].
Shema 1. Patogeneza nefropatije izazvane
cilindrima kod multiplog mijeloma
Fig.1. Pathogenesis of myeloma cast nephropathy
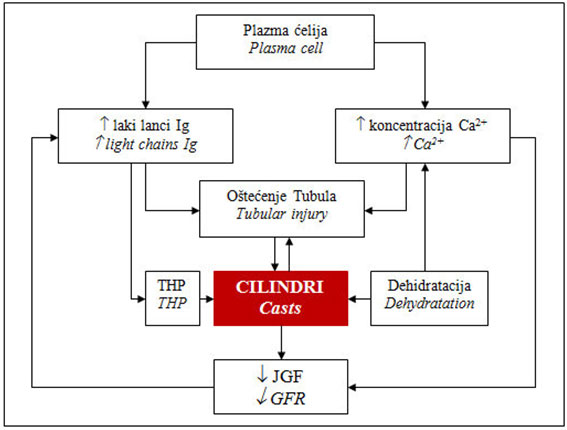
THP - Tamm-Horsfall-ov protein, JGF - jačina glomerulske filtracije,
Ig - imunoglobulini
THP - Tamm-Horsfall proteins, GFR - glomerular filtration rate, Ig -
immunoglobulins
Modifikovano prema Goldschmidt i ost [15].
Modified according to Goldschmidt et al. [15].
Akutno oštećenje bubrega u multiplom mijelomu
Nefropatija izazvana cilindrima („cast nephro-pathy“, mijelomski
bubreg) je direktno povezana sa povećanom koncentracijom
monoklonskih slobo-dnih lakih lanaca u serumu - FLC. Kod svih
bole-snika sa akutnim ošteće-njem bubrega, kod kojih je poremećen
odnos k/λ lanaca u serumu i kod kojih je visoka koncentracija
slobodnih kapa - k-FLC ili lambda lakih lanaca - λ-FLC u serumu
(≥500 mg/l), postoji osnovana sumnja na nefropatiju izazvanu
cilindrima („cast nephropathy“), odnosno na mije-lomski bubreg,
shema 2 [1,11]. Primena nestero-idnih antireumatika za sanaciju
koštanog bola, hiperkalcemija, česte i povratne infekcije i stanja
praćena smanjenjem zapremine krvi u arterijskoj cirkulaciji
povećavaju kliničku sumnju na razvoj mijelomskog bubrega.
Potvrđivanje nefropatije izazvane cilindrima (mijelomski bubreg)
zahteva biopsiju bubrega, posebno kod bolesnika kod kojih je
koncentracija slobodnih lakih lanaca u serumu jednaka ili veća od
500 mg/l, shema 2 [1,11]. Rezultati kliničkih ispitivanja pokazuju
da nema statistički značajne razlike u javljanju komplikacija
(značajna krvarenja) posle biopsije bubrega između bolesnika koji
boluju (4,3%) i onih koji ne boluju od monoklonskih gamapatija
(3,7%) [23].
Shema 2. Algoritam za skrining monoklonske bolesti
i akutnog oštećenja bubrega
Fig.2. Screening algorithm for monoclonal disease in acute kidney
injury
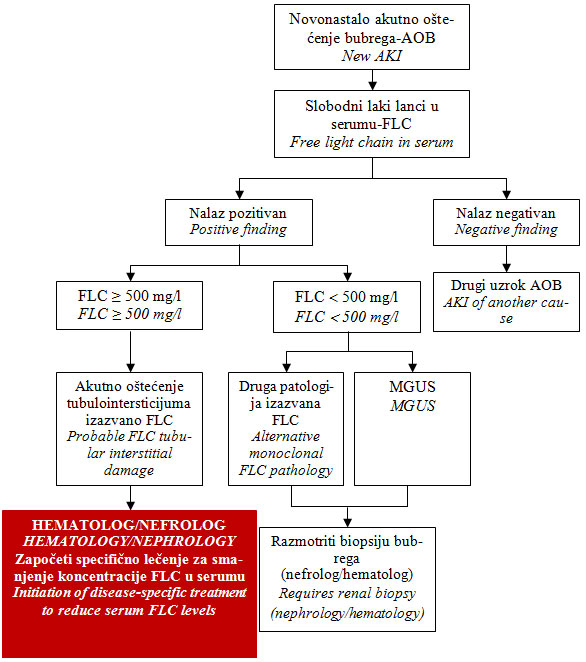
AOB - akutno oštećenje bubrega, FLC - slobodni
laki lanci u serumu, MGUS - monoklonska gamapatija neutvrđenog
značaja
AKI - acute kidney injury, FLC - free light chain, MGUS - monoclonal
gammapathy of undertermined signi-ficance
Modifikovano prema Hutchison i ost. [11].
Modified according to Hutchison et al. [11].
Procena funkcije bubrega kod bolesnika sa
multiplim mijelomom i oštećenjem bubrega
Kod bolesnika sa multiplim mijelomom i stabilnom koncentracijom
kreatinina u serumu (hronična bubrežna insuficijencija) funkcija
bubrega se proce-njuje izračunavanjem JGF uz pomoć MDRD
(Mo-dification of Diet in Renal Disease) formule: JGF
(ml/min/1.73m2) = 186 x (Scr/88.4)-1.154 x godine-0.203 x (0.742 za
Ž) x 1.212 (za crnu rasu) [24]. Kod zdravih osoba (u odsustvu
bolesti) pro-cenjena jačina glomerulske filtracije je u rangu od
90-130 ml/min/1.73m2 [24]. Na osnovu izračunate JGF, prema
preporukama KDIGO (Kidney Disease Improving Global Outcomes
classification) razli-kujemo pet stadijuma hroničnog oštećenja
bubrega, tabela 2 [24].
Za procenu težine akutnog oštećenja bubrega kod bolesnika koji
boluju od MM koristi se RIFLE/ AKIN (Risk, Injury, Failure, Loss and
End-stage kidney disease/Acute Renal Injury Network) klasi-fikacija,
tabela 3 [24,25]. Prema klasifikaciji RIFLE, akutno oštećenje
bubrega se definiše kao naglo (unutar 1-7 dana) i neprekidno (>24h)
sma-njenje funkcije bubrega (povećanje koncentracije serumskog
kreatinina za ≥ 50%). Klasifikacija AKIN akutno oštećenje bubrega
definiše kao naglo nastalo smanjenje funkcije bubrega (unutar 48h)
praćeno apsolutnim porastom koncentracije kreati-nina u serumu za ≥
0.3 mg/dl (≥ 26.4 µmol/l) [24,25].
Prognoza bolesnika zavisi i od stepena oporavka funkcije bubrega. Za
definisanje oporavka funkcije bubrega kod bolesnika koji boluju od
MM posle odgovarajućeg lečenja koriste se kriterijumi bazi-rani na
procenjenoj jačini glomerulske filtracije (MDRD formula) [24]. Prema
preporukama IKMGRG (International Kidney and Monoclonal Gammopathy
Research Group), kompletan odgovor bubrega (CRenal) se definiše kao
neprekidno (traje najmanje dva meseca) poboljšanje/popravljanje
klirensa kreatinina od vrednosti manjih od 50 ml/min, kao početnih,
na vrednosti ≥ 60 ml/min. Parcijalni odgovor bubrega (PRenal) se
definiše kao trajno poboljšanje početnog klirensa kreatinina manjeg
od 15 ml/min na vrednosti od 30-59 ml/min. Mali/minimalni odgovor
bubrega (MRenal) se definiše kao trajno poboljšanje početnog
klirensa od vrednosti manje od 15 ml/min na vrednosti od 15-29
ml/min, ili trajno poboljšanje od vrednosti 15-29 ml/min na
vrednosti od 30-59 ml/min [23]. Kompletan odgovor bubrega se
ostvaruje u 30% bolesnika koji su lečeni protokolima koji sadrže
bortezomib [24].
Tabela 2. Klasifikacija hroničnog oštećenja
bubrega
Table 2. Classification of chronic renal disorders

JGF (ml/min/1.73m2) = 186 x (Scr/88.4)-1.154 x
godine-0.203 x (0.742 za Ž) x 1.212 (za crnu rasu)
GFR (ml/min/1.73m2) = 186 x (Scr/88.4)-1.154 x age-0.203 x (0.742 if
female) x 1.212 (if black);
Stadijum 5 se definiše kao završni stadijum hronične bolesti
bubrega, Stage 5 is defined as end-stage renal disease;
Modifikovano prema Dimopoulos i sar. [22].
Modified according to Dimopoulos et al. [22].
Lečenje multiplog mijeloma
Lečenje simptomatskog multiplog mijeloma treba započeti odmah.
Odluka o početnom pristupu leče-nja boles-nika zavisi od mnogih
faktora: stadijuma bolesti, kliničkog ispoljavanja (indolentni,
siste-mski, ili ekstramedu-larni mijelom), starosti bole-snika, tj.
podobnosti za lečenje visokodoznom hemioterapijom, prisustva
bubrežnog oštećenja, opšteg stanja bolesnika, pridruženih bolesti
(kardiovaskularna oboljenja, dijabetes, prisustvo trombofilije i
drugih trombogenih stanja), kao i prognostičkog profila. U
zavisnosti od ovih kriterijuma, za svakog pojedinačnog bolesnika
potrebno je definisati cilj lečenja i plan lečenja. Bolesnici u IA
kliničkom stadijumu bez simptoma ne zahtevaju primenu specifičnog
hematološkog lečenja. Kod ovih bolesnika je potrebno pratiti
hematološki status u tromesečnim intervalima [26].
Tabela 3. RIFLE/AKIN klasifikacija akutnog
oštećenja bubrega
Table 3. RIFLE and AKIN criteria of acute kidney injury
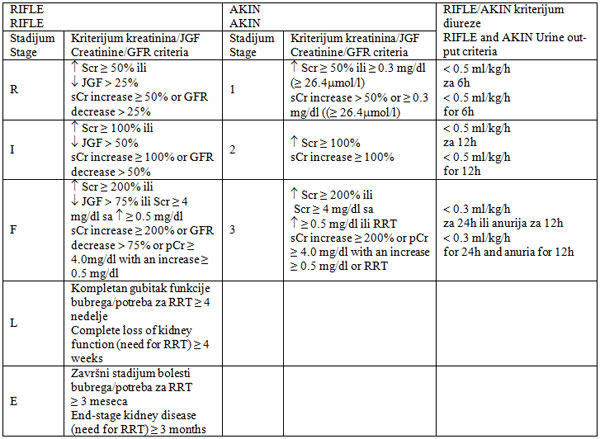
RIFLE/AKIN - Risk, Injury, Failure, Loss and End-stage kidney
disease/Acute Renal Injury Network); Scr - koncentracija kreatinina
u serumu, sCr - serum creatinine; RRT - metode za zamenu funkcije
bubrega/renal replacement therapy
Modifikovano prema Dimopoulos i sar. [22].
Modified according to Dimopoulos et al. [22].
Novodijagnostikovani bolesnici mlađi od 65 godina, u II i III
stadijumu bolesti, leče se prime-nom hemioterapij-skih kombinacija
sa talidomidom ili bortezomibom [27-29]. Terapijski izbor zavisi od
individualnog profila bolesnika: prisustva bubrež-nog oštećenja,
opšteg stanja, prisustva kardiova-skularnih oboljenja, trombofilije
i drugih trombo-genih stanja, specifičnih citogenetskih poremećaja,
ekstramedularnog oblika bolesti. Kod boles-nika mlađih od 65 godina,
bez oštećenja bubrega, posle primene indukcione hemioterapije i
postignute parcijalne remisije (PR), lečenje se nastavlja prime-nom
visokodozne hemioterapije i autologe transpla-ntacije matične ćelije
hematopoeze (TMĆH) [27-29]. Bolesnici sa oštećenjem bubrega koji
zahte-vaju hemodijalizu, mogu se lečiti i visokim dozama
deksametazona (2 ciklusa) uz nastavak lečenja primenom
hemioterapijskih protokola, zavisno od oporavka funkcije bubrega
[27-29].
Novodijagnostikovani bolesnici stariji od 65 godina, u II i III
stadijumu bolesti, leče se prime-nom hemioterapij-skih režima
zasnovanih na melfa-lanu, talidomidu i bortezomibu [27-29]. Cilj
lečenja ovih bolesnika je produžiti ukupno preživljavanje, uz
održavanje dobrog opšteg stanja i smanjenje neophodnosti bolničkog
lečenja u najvećoj mogućoj meri. Ovi bolesnici nisu kandidati za
TMĆH. I kod ovih bolesnika, koji imaju bubrežnu insuficijenciju i
leče se hemodijalizom, mogu se primeniti visoke doze deksametazona
(2 ciklusa), a nakon toga, zavisno od oporavka funkcije bubrega, već
po-menuti hemioterapijski modaliteti [27-29].
Indukcija remisije kod bolesnika koji boluju od bolesti deponovanja
lakih lanaca - LCDD se postiže primenom bortezomiba i deksametazona,
a kod bolesnika koji boluju od amiloidoze - AL prime-nom melfalana i
deksametazona [10,17,19,20, 30,31].
Suportivna terapija sastoji se u obnavljanju zapre-mine
intravaskularnog volumena, primeni bifo-sfonata (u skladu sa
stepenom funkcije bubrega), primeni eritropoetina (u skladu sa
stepenom ane-mije) i u prekidu upotrebe nestereoidnih
antii-nflamatornih lekova i kontrastnih sredstava [15].
Lečenje multiplog mijeloma i akutnog oštećenja bubrega
Bolesnici koji boluju od multiplog mijeloma i akutnog oštećenja
bubrega zahtevaju rano dijagno-stikovanje bolesti i brzo smanjenje
koncentracije monoklonskih slobodnih lakih lanaca u serumu. Brzo i
kontinuirano smanjenje koncentracije lakih lanaca u serumu - FLC (>
50%), u prve tri nedelje od započinjanja lečenja povezano je sa
oporavkom funkcje bubrega. Koncentracija monoklonskih lakih lanaca u
serumu smanjuje se istovremenim blokiranjem stvaranja i njihovim
odstranjivanjem iz seruma bolesnika [1]. Blokiranje pojačanog
stvaranja monoklonskih lakih lanaca postiže se primenom
hemioterapije, a njihovo odstranjivanje iz seruma se postiže
plazmaferezom i high „cut-off“ hemodijalizom (HCO membrana sa
velikim porama) [1,32,33].
Prema preporukama IMWG (International Myeloma Working Group) za
lečenje MM i akutnog oštećenja bubrega (mijelomski bubreg/cast
nephropathy) primenjuje se bortezomib u kombi-naciji sa
deksametazonom [33,34]. Bortezomib je blokator proteozoma i deluje
preko više meha-nizama: blokira signalni put IL-6, blokira stvaranje
VEGF (Vascular Endothelial Growth Factor), kao i aktivnost
nuklearnog faktora kapa B - NFkB u izmenjenim plazma ćelijama, a sve
to za posledicu ima apoptozu ovih ćelija. Bortezomib takođe blo-kira
i NFkB u epitelnim ćelijama proksimalnih tu-bula bubrega, sprečava
zapaljenje i ožiljavanje tubulointersticijuma i doprinosi oporavku
funkcije bubrega [34].
Kod bolesnika koji boluju od multiplog mijeloma, plazmafereza je
indikovana ukoliko se razvije akutno oštećenje bubrega, kao
posledica visoke koncentracije slobodnih lakih lanaca u serumu (FLC
≥ 500 mg/l) i nefropatije izazvane cilindrima (cast nephropathy),
kao i kod bolesnika sa hipervi-skoznim sindromom (IgG > 40 g/l, IgA
> 60 g/l, IgM > 30 g/l) [35,36]. Plazmafereza se primenjuje
svakodnevno ili svaki drugi dan, u toku 7-10 dana (seansi). U toku
pojedinačne seanse plazmafereze menja se 1.0 volumen plazme (2800 ml
plazme), a za supstituciju plazme se koristi 5% rastvor albu-mina
[36]. Kod bolesnika kod kojih se plazma zamenjuje 5% rastvorom
albumina, postoji rizik od krvarenja zbog smanjenja koncentracije
faktora koagulacije („depleciona koagulopatija“) [16,36]. Posle
pojedinačne sesije plazmafereze protrom-binsko vreme - PT se
povećava za 30%, a parci-jalno tromboplastinsko vreme - aPTT
dvostruko. Zbog toga je kod ovih bolesnika nephodan moni-toring
koagulacionog statusa (INR, aPTT) posebno pre i posle treće seanse
plazmafereze, kao i moni-toring koncentracije fibrinogena. Kod
bolesnika kod kojih je koncentracija fibrinogena u serumu manja od
1.25 g/l, preporučuje se supstitucija sa 5% rastvorom albumina i
svežom smrznutom plazmom (manji deo supstitucije) [16,36]. Pored
smanjenja koncentracije faktora koagulacije, smanjuje se i
koncentracija normalnih imunoglobulina (izmenom jednog volumena
plazme koncentracija normalnih imunoglobulina u serumu se smanjuje
za 60%) („deplecija normalnih imunoglobulina“), a pojedini bolesnici
zbog povećanog rizika od infekcije zahtevaju primenu imunoglobulina
(i.v. 100-400 mg/kg) [16,36]. Komplikacije plazmafereze nisu česte i
uglavnom su povezane sa centralnim venskim kateterom, alergijskim
reakcijama na svežu smrznutu plazmu i hipokalcemijom [16,36].
Rezultati kliničkih ispitivanja pokazuju da je HCO hemodijaliza (HCO
1100 dijalizator, Qd = 500 ml/min, Qb = 250 ml/min) efikasnija u
odstranji-vanju monoklonskih lakih lanaca imunoglobulina iz seruma
bolesnika u odnosu na plazmaferezu [37-39]. Precizni matematički
modeli pokazuju da se lečenjem plazmaferezom u toku tri nedelje
odstranjuje 25% od ukupne količine monoklonskih slobodnih lanaca iz
intra- i ekstravaskularnog prostora, a HCO hemodijalizom za isti
vremenski period se odstranjuje i do 90% lakih lanaca [37-39].
Trajanje pojedinačne HCO hemodijalize iznosi od 4-10h, u zavisnosti
od koncentracije monoklonskih slobodnih lakih lanaca u serumu i
kliničkog stanja bolesnika [37-39]. Najčešće se HCO hemodijaliza
primenjuje svakodnevno u toku 5 dana, u trajanju od po 8h, zatim
svaki drugi dan u trajanju od 8h u narednih 12 dana, a lečenje se
nastavlja sa HCO hemodijalizom tri puta nedeljno po 6h u toku tri do
šest nedelja [37-39]. Za vreme produžene seanse HCO hemodijalize
veoma je važno praćenje koncentracije albumina i njihova
supstitucija posle pojedinačne seanse (20% humani albumini 100 ml)
[37-39]. Oporavak funkcije bubrega se definiše kao odsustvo potrebe
za hemodijalizom u periodu od dve nedelje posle poslednje
hemodijalize ili kao procenjena minimalna jačina glomerulske
filtracije > 10 ml/min/1,73m2 [37-39]. Koncentracija
mono-klonskih slobodnih lakih lanaca u serumu se procenjuje
nefelometrijski 5., 12. i 21. dana posle istovremene primene
hemioterapije (bazirane na primeni bortezomiba) i HCO hemodijalize
[37-39]. Kada se koncentracija monoklonskih slobodnih lanaca u
serumu smanji na vrednosti < 500 mg/l, bolesnik lečenje nastavlja
standardnom hemodijalizom u skladu sa medicinskim indikacijama
[37-39].
ZAKLJUČAK
Multipli mijelom sa akutnim oštećenjem bubrega zahteva brzu
dijagnostiku, pravovremenu primenu odgovarajućeg lečenja
(istovremena primena hemioterapije i terapijskog postupka za
odstranjivanje monoklonskih lakih lanaca iz seruma bolesnika),
timski rad i odgovarajuće praćenje bolesnika (hematolog/nefrolog).
Oporavak funkcije bubrega kod ovih bolesnika znači i njihovo duže
preživljavanje (bolji ishod bolesnika).
LITERATURA
- Cockwell P, Hutchison CA. Management options for cast
nephropathy im multiple myeloma. Curr Opinion Nephrol Hypertens
2010; 19(6): 550-5.
- Morabito F, Gentile M, Mazzone C, Bringhen S, Vigna E, Lucia
E et al. Therapeutic approaches for newly diagnosed multiple
myeloma patients in the era of novel drugs. Eur J Hematology
2010; 85(3): 181-91.
- Palumbo A, Anderson K. Multiple Myeloma. N Engl J Med 2011;
364(11):1046-60.
- Healy CF, Murray JG, Eustace SJ, Madewell JO,Gorman PJO,
O,Sullivan PO. Multiple Myeloma: A Review of Imaging Features
and Radiological Techiques. Bone Marrow Res 2011; doi:
10.1155/2011/583439.
- Đurđević P, Anđelković N, Bila J. Savremena dijagnostika i
prognostički faktori kod bolesnika sa multiplim mijelomom. Srp
Arh Celok Lek 2011; 139:Suppl 2:95-102.
- International Myeloma Working Group. Criteria for the
classification of monoclonal gammopathies, multiple myeloma and
related disorders: a report of the International Myeloma Working
Group. Br J Hematol 2003; 121(5):749-57.
- Rajkumar SV, Kyle RA. Multiple myeloma: diagnosis and
treatment: Mayo Clinic Proc 2005; 80(10): 1371-82.
- Veillon DM, Cotelingam JD. Pathologic Studies Useful for the
Diagnosis and Monitoring of plasma Cell Dyscrasias. In: The
Kidney in Plasma Cell Dyscrasias. Herrera GA (ed). Contrib
Nephrol. Basel: Karger; 2007. p. 25-43.
- Radović V, Mijušković Z, Tukić Lj, Đjurđević P, Stojanović
J, Zlatković M. Free ligh chains ratio as a marker to estimate
prognosis and survival in patients with multiple myeloma and
primary amyloidosis. J BUON 2012; 17(1): 110-5.
- Comenzo RL. Current and Emerging Views and Treatments of
Systemic Immunoglobulin Light-Chain (AL) Amyloidosis. In: The
Kidney in Plasma Cell Dyscrasias. Herrera GA (ed). Contrib
Nephrol. Basel: Karger; 2007. p. 195-210.
- Hutchison CA, Batuman V, Behrens J, Bridoux F, Sirac C,
Dispenzieri A et al. for International Kidney and Monoclonal
Gammopathy research Group. The pathogenesis and diagnosis of
acute kidney injury in multiple myeloma. Nat Rev Nephrol 2011;
8(1): 43-51.
- Stojimirović B, Petrović D. Proteinurija: dijagnostička
strategija bazirana na određivanju različitih proteina mokraće.
Srp Arch Celok Lek 2004; 132(3-4):127-32.
- Batuman V. Proximal Tubular Injury in Myeloma. In: The
Kidney in Plasma Cell Dyscrasias. Herrera GA (ed). Contrib
Nephrol. Basel: Karger; 2007. p. 87-104.
- Herrera GA, Sanders PW. Paraproteinemic Renal Diseases that
Involve the Tubulo-Interstitium. In: The Kidney in Plasma Cell
Dyscrasias. Herrera GA (ed). Contrib Nephrol. Basel: Karger;
2007. p. 105-115.
- Neuwirt H, Rudniciki M, Schramek H, Mayer G. Monoclonal
light chains and the kidney. Nephrology Rev 2011; 3(1): 13-22.
- Goldschmidt H, Lannert H, Bommer J, Ho AD. Multiple myeloma
and renal failure. Nephrol Dial Transplant 2000; 15(1): 301-4.
- Leung N, Rajkumar V. Renal Manifestations of Plasma Cell
Disorders. Am J Kidney Dis 2007; 50(1): 155-65.
- Jimenez-Zepeda VH. Light chain deposition disease: novel
biological insights and treatment advances. Int J Lab Hematology
2012; 34(4):347-55.
- Ronco P, Plaisier E, Mougenot B, Aucouturier P.
Immunoglobulin Light (Heavy)-Chain Deposition Disease: From
Molecular Medicine to Pathiphysiology-Driven Therapy. Clin J Am
Soc Nephrol 2006; 1(6):1342-50.
- Korbet SM, Schwartz MM. Multiple Myeloma. J Am Soc Nephrol
2006; 17(9): 2533-45.
- Heher EC, Goes NB, Spityer TR, Raje NS, Humphreys BD,
Anderson KC, Richardson P. Kidney disease associated with plasma
cell dyscrasias. Blood 2010; 116(9): 1397-404.
- Petrović D, Milovanović D, Nikolić A, Đurđević P, Petrović
M. Sindrom lize ćelija tumora i akutno oštećenje bubrega. Pons
Med C 2011; 8(3):95-8.
- Fish R, Pinney J, Jain P, Addison C, Jones C, Jayawardene S
et al. The Incidence of Major Hemorrhagic Complications After
Renal Biopsies in Patients with Monoclonal Gammopathies. Clin J
Am Soc Nephrol 2010; 5(11):1977-80.
- Dimopoulos MA, Terpos E, Chanan-Khan A, Leung N, Ludwig H,
Jagannath S et al. Renal Impairment in Patients With Multiple
Myeloma: A Consensus Statement on Behalf of the International
Myeloma Working Group. J Clin Oncol 2010; 28(33): 4976-84.
- Petrović D. Akutno oštećenje bubrega: etiologija,
dijagnostika i lečenje. Medicinska Istraživanja 2011; 45(3):
7-13.
- Harousseau JL, Dreyling M. On behalf of the ESMO Guidelines
Working Group. Multiple myeloma: ESMO clinical recommendations
fod diagnosis, treatment and follow-up. Ann Oncol 2008; 19:Suppl
2:55-7.
- San Miguel J, Harousseau JL, Joshua D, Anderson KC.
Individualizing treatment of patients with myeloma in the era of
novel agents. J Clin Oncol 2008; 26(16):2761-6.
- Palumbo A, Rajkumar SV. Treatment of newly diagnosed
myeloma. Leukemia 2009; 23(3):449-56.
- Dispenzieri A, Rajkumar SV, Gertz MA, Fonseca R, Lacy MQ,
Berqsagel PL et al. Treatment of newly diagnosed multiple
myeloma based on Mayo stratification of myeloma and risk-adapted
therapy (mSMART): Consensus statement. Mayo Clin Proc 2007;
82(3): 323-41.
- Palumbo A, Rajkumar V. Multiple myeloma: chemotherapy or
transplantation in the era of new drugs. Eur J Haematol 2010;
84(5): 379-90.
- Hutchison CA, Blade J, Cockwell P, Cook M, Drayson M,
Fermand JP et al. For International Kidney and Monoclonal
Gammopathy Research Group. Novel approaces for reducing free
light chains in patients with myeloma kidney. Nat Rev Nephrol
2012; 8(4): 234-43.
- Gakhar B, Kobrin S, Berns JS. Extracorporeal Treatment of
Cast Nephropathy. Semin Dial 2011; 24(1): 9-11.
- Stringer S, Basanayake K, Hutchison C, Cockwell P. Recent
Advances in the Pathogenesis and Management of Cast Nephropathy
(Myeloma Kidney). Bone Marr Res 2011: ID 493697.
- Gaballa MR, Laubach JP, Schlossman RL, Redman K, Noonan K,
Mitsiades CS et al. Management of myeloma-associated renal
dysfunction in the era of novel therapies. Expert Rev Hematol
2012; 5(1): 51-68.
- Gupta D, Bachegowda L, Phadke G, Boren S, Johnson D, Misra
M. Role of plasmapheresis in the management of myeloma kidney: A
systematic review. Hemodialysis Int 2010; 14(4):355-63.
- Pusey CD, Levy JB. Plasmapheresis in Immunologic Renal
Disease. Blood Purif 2012; 33(1-3):190-8.
- Hutchison CA, Cockwell P, Reid S, Chandler K, Mead GP,
Harrison J et al. Efficient Removal of Immunoglobulin Free Light
Chains bz Hemodialysis for Multiple Mzeloma: In Vitro and In
Vivo Studies. J Am Soc Nephrol 2007; 18(3):886-95.
- Hutchison CA, Bradwell AR, Cook M, Basnayake K, Basu S,
Harding S et al. Treatment of Acute Renal Failure Secondary to
Multiple Myeloma with Chemotherapy and Extended High Cut-Off
Hemodialysis. Clin J Am Soc Nephrol 2009; 4(4):745-54.
- Cockwell P, Hutchison CA. Management options for cast
nephropathy in multiple myeloma. Curr Opin Nephrol Hypertens
2010; 19(6):550-5.
Zahvalnost Ministarstvu za prosvetu, nauku i tehnološki razvoj
Republike Srbije za projekat broj 175014, čija su sredstva korišćena
kao jedan od izvora za finansijsku podršku ovog stručnog rada.
Zahvalnost Ministarstvu za prosvetu, nauku i tehnološki razvoj
Republike Srbije za projekat broj III41010, čija su sredstva
korišćena kao jedan od izvora za finansijsku podršku ovog stručnog
rada.
|
|
|
|





