 |
Glasilo Podru¾nice Srpskog lekarskog dru¹tva Zaječar
Godina 2004 Volumen 29 Broj
3 |
|
|
|
|
[ Home ] [ Gore/Up ][ <<< ] [ >>> ]
|
|
| |
UDK: 615.222.06:616.44-073 |
ISSN 0350-2899,
29(2004) 3 p.157-163 |
|
| |
Originalni radVrednosni in vivo tireoidnih testova - scintigrafije
¹titaste ¾lezde Tehnecijum Pertehnetatom, testa akumulacije Tehnecijum
Pertehnetata (TcU) i testa radiojodne fiksacije (RAIU) kod pacijenata na
terapiji Amiodaronom -
poku¹aj vizualizacije ¹titaste ¾lezde sa 99mTC-MIBI
®eljka Aleksię, Aleksandar Aleksię
Zdravstveni centar Zaječar, Slu¾ba za nuklearnu medicinu, Zaječar |
|
| |
|
|
| |
Sa¾etak:
Amiodaron (AMD) je potentni antiaritmik bogat jodom. Pacijenti na terapiji
ovim lekom unose prekomerne količine joda. Kod 42 pacijenta, 20
eutiroidnih na terapiji sa AMD, i 22 sa supkliničkim ili kliničkim
tireoidnim disfunkcijama (TD) izazvanim amiodaronom, uradili smo jedan ili
vi¹e in vivo tireoidnih testova – statičku scintigrafiju ¹titaste ¾lezde (©®)
tehnecijum pertehnetatom, test akumulacije tehnecijum pertehnetata (TcU)
ili test radiojodne fiksacije (RAIU). Kod svih, sem dva eutireodna
pacijenta, ¹titasta ¾lezda je bila “blokirana”. Preostala dva pacijenta
imala su funkcionalne noduse u ©®, koji su se dobro prikazali bez obzira
na optereęenje jodom. Amiodaronom indukovane tireotoksikoze (AIT)
pokazivale su ili očuvano ili pojačano vezivanje, AIT tip 1, ili sni¾eno
vezivanje obele¾ivača, AIT tip 2. Kod jednog pacijenta sa amiodaronom indukovanim
hipotiroidizmom (AIH) i jednog sa supkliničkim hipotireoidizmom našena je
normalna vrednost RAIU za 3h. Kod pacijenata sa supkliničkim
hipertiroidizmom bilo je različitih nalaza. Kod 7 pacijenata urašena je i
scintigrafija ©® sa 99mTc-MIBI. Vizualizacije ©® sa 99mTc-MIBI
bila je dobra samo u jednog, supklinički hipotireodnog pacijenta.
Scintigrafija tehnecijum pertehnetatom, TcU i RAIU mogu biti korisni in
vivo testovi za diferencijaciju AIT tip 1 i AIT tip 2.
Ključne reči: amiodaron, scintigrafija ¹titaste ¾lezde tehnecijum
pertehnetatom, radiojodna fiksacija, test akumulacije pertehnetata,
scintigrafija ¹titaste ¾lezde sa 99mTc-MIBI
Napomena: sa¾etak na engleskom jeziku
Note: summary in English |
|
| |
|
|
| |
|
|
| |
UVOD
Pacijenti koji se zbog refrakternih aritmija leče amiodaronoma (AMD),
antiaritmikom bogatim jodom, izlo¾eni su hronično poveęanom oralnom unosu
joda.
Amiodaron je derivat benzofurana koji sadr¾i dva atoma joda po molekulu,
odnosno jod čini 37,2% te¾ine molekula. To znači da u svakoj kapsuli od
200 mg amiodarona ima oko 75 mg organskog joda. Nakon oralne primene, on
se nepotpuno i sporo apsorbuje iz GIT-a. Sisitemska biolo¹ka raspolo¾ivost
pokazuje velike varijacije i kreęe se od 22-80%. Izmešu 8% i 17% joda iz
AMD oslobaša se u cirkulaciji kao neorganski jod, ¹to čini 3 mg
neorganskog joda na 100 mg AMD svakog dana.
Jodid se u tireocite transportuje nasuprot električnog i hemijskog
gradijenta. Sposobnost tireocita da koncentri¹u jodid u fiziolo¹kim
uslovima je znatna. Koncentracija jodida u ¹titastoj ¾lezdi (©®) je 20-40
puta veęa od koncentracije u plazmi. Jodid koji se dopremi u tireocit,
mo¾e biti oksidisan i organifikovan ili slobodno difunduje nazad u
ekstraęelijsku tečnost. 1-4
Tireoidni transport jodida ispunjava sve kriterijume aktivnog transporta.
Aktivni transport jodida u ©® posredovan je Na+-I-
simporterom (NIS), intrinzičnim membranskim proteinom. Monovalentni anjoni
slične veličine, oblika i istog električnog naboja kao jodid takoše se
mogu koncentrisati u ©®. Anjoni ClO3-, TcO4-, SCN-,
SeCN-, NO3-, Br-, BF4-, IO4-,
BrO3- su kompetitivni inhibitori transporta jodida u ©®. 5 |
|
| |
|
|
| |
|
|
| |
CILJ RADA
Cilj nam je bio da u populaciji na¹ih pacijenata na terapiji
amiodaronom, sa ili bez tireoidne disfunkcije(TD) indukovane amiodaronom,
ispitamo vrednosti in vivo testova (scintigrafije ©®, fiksacije radiojoda
– RAIU i akumulacije pertehnetata – TcU). Osim toga, kod jednog broja
pacijenata, poku¹ali smo vizualizaciju ©® sa 99mTc-MIBI (metoksi-izobutil-izonitril),
čija je akumulacija u ©® nezavisna od TSH I joda. |
|
| |
|
|
| |
|
|
| |
PACIJENTI I METODE
Kod ukupno 42 pacijenta, prosečne starosti 52.95±11.13
godina (29-71) na terapiji AMD-om od 20.44±25.01
meseci, medijana 12 (1-120) urašen je neki od in vivo tiroidnih testova.
Urašeno je 25 statičkih scintigrafija ©® tehnecijum-pertehnetatom, 18
testova akumulacije tehnecijum-pertehnetata, 12 radiojodnih fiksacija i 7
scintigrafija ©® pomoęu 99mTc-MIBI. Svim pacijentima urašeni su
i biohemijski testovi tiroidne funkcije, kao i klinička procena tiroidnog
statusa.
Nivo ukupnih tireoidnih hormona, TT4 i TT3 odrešivan je RIA metodom (RIA
TT4 i RIA TT3 Institut za nuklearne nauke "Vinča"), sa opsegom normalnih
vrednosti 51.5-160 nmol/L za TT4 i 1.33-3.1 nmol/L za TT3. Nivo slobodnih
frakcija tireoidnih hormona odrešivan je metodom DELFIA (DELFIA FT4 i
DELFIA FT3 Wallac Oy, Turku, Finland). Opseg normalnih vrednosti slobodnih
frakcija tireoidnih hormona su 9.25-25 pmol/L za FT4 i 3.5-9.0 pmol/L za
FT3. TSH je meren ultrasenzitivnom DELFIA metodom (DELFIA hTSH Ultra
Wallac Oy, Turku, Finland) sa referentnim opsegom od 0.1-4 mU/L.
Merenje fiksacije radiojoda (131I) vr¹eno je nakon 3 i/ili 24
sata od peroralne primene oko 10 μCi (0.37 MBq) Na131I
scintilacionom sondom sa kristalom NaI (Tl), 3x3 inča i divergentnim
kolimatorom pravolinijskog skenera Pho/Dot Scanner, Nuclear Chicago. Opseg
referentnih vrednosti fikasacije radiojoda je 8-20% za 3 sata i 20-45% za
24 sata. Kratki test fiksacije 99mTcO4- (TcU)
izvošen je na gama kameri PHO/GAMMA IV Searle Radiographics sa LPP
kolimatorom, tako ¹to se nakon intravenske primene oko 1.5-2 μCi (50-80
MBq) tehnecijum pertehnetata, kontinuirano merila radioaktivnost nad ©® u
toku 5 minuta. Kori¹ęen je program HISTO i iz regiona od interesa nad ©®
dobija se kriva aktivnost/vreme, a TcU se izračunava iz odnosa prira¹taja
(slope) aktivnosti izra¾enog u impulsima u sekundi i aktivnosti nad
graničnikom A koji deli zavr¹etak "vaskularne" faze od početka rane
akumulacije. Prira¹taj se meri u linearnom delu krive omešenom graničnikom
A i graničnikom B, koji se postavlja na kraj linearnog prira¹taja
(najče¹ęe oko 3. minuta). Izračunavanje se vr¹i mno¾enjem proizvoda
prira¹taja i aktivnosti nad A sa 1000. Vrednosti iznad 5 su povi¹ene, a
ispod 1 sni¾ene 6. Scintigrafija ©® rašena je nakon 15-20
minuta po intravenskoj primeni oko 1 mCi (37MBq) tehnecijum-pertehnetata (99mTcO4-),
ili 6-8 mCi (222-296 MBq) 99mTc - MIBI (sestamibi) na gama
kameri Simens Diacam. Svi in vivo i in vitro testovi rašeni su u
nuklearnomedicinskoj laboratoriji Zdravstvenog centra u Zaječaru. |
|
| |
|
|
| |
|
|
| |
REZULTATI
Dobijeni rezultati prikazani su u tabeli 1. i na slikama 1, 2 i 3. Statička scintigrafija sa tehnecijum pertehnetatom urašena je kod 12
eutiroidnih (EU) pacijenata na terapiji sa AMD Kod njih 10 bilo je odsutno
vezivanje obele¾ivača u ©® – »blokirana« ©®. Kod istih pacijenata indeks
TcU bio je nizak, ispod 1. Kod preostala 2 EU pacijenta scintigrafijom su
se prikazali funkcioni nodusi.
Kod jednog pacijenta sa amiodaronom indukovanim hipotireoidizmom (AIH) kod
kog je rašena scintigrafija pertehnetatom dobijen je normalan scintigram
©®.
Kod 7 pacijenata sa AIT urašena je statička scintigrafija pertehnetatom.
Kod 2 pacijenta otkriveni su toksični adenomi, a kod jednog difuzna
toksična struma, a nalazi su imali dijagnostički značaj u smisli AIT tip
1. Kod preostala 4 pacijenta sa AIT, scintigrafija i TcU pokazivali su
“blokiranu” ©® – AIT tip 2.
Od 5 pacijenata sa supkliničkim hipertiroidizmom, sa suprimiranim uTSH I
normalnim nivoom tireoidnih hormona, kod 3 je našena »blokirana« ©®, a kod
2 dobijen normalan scintigram ©®.
RAIU je urašen kod 12 pacijenata. Od 5 EU pacijenata, kod svih sem jednog
kod kog je bila normalna, vrednost testa je bila sni¾ena. Kod 5 pacijenata
sa AIT, nivo RAIU je takoše bio sni¾en, AIT tip 2. Kod jednog pacijenta sa
AIH i jednog sa supkliničkim hipotireoidizmom fiksacija radiojoda za 3
sata bila je normalna (9% i 10% redom).
99mTc-MIBI scan ©® rašen je kod 7 pacijenata. - kod 3 EU
pacijenta, 2 sa AIT, 1 supklinički hipotireoidnog i 1 supklnički
hipertireoidnog.
Dobra vizualizacija i normalne morfolo¹ke karatkteristike ©® dobijeni samo
kod 1 pacijenta koji je supklinički hipotireodan.
Starost pacijenata, pol i du¾ina terapije sa AMD nisu imali značaj za
dobijene rezultate in vivo testova. |
|
| |
|
|
| |
| PACIJENT |
POL |
STAROST |
SCINTIGRAFIJA |
TcU |
RAIU |
VRSTA DISFUNKCIJE |
AMD (m) |
| 290/ 8 |
Z |
68 |
/ |
/ |
9 |
A I H |
48 |
| 444/ 8 |
M |
53 |
NORMALNA ©® |
/ |
/ |
A I H |
3 |
| 259/ 4 |
Z |
37 |
TOKSIČNI ADENOM |
/ |
/ |
A I T 1 |
60 |
| 476/ 4 |
M |
61 |
TOKSIČNI ADENOM |
/ |
/ |
A I T 1 |
12 |
| 168 |
Z |
44 |
DIFFUSA TOXICA |
/ |
/ |
A I T 1 |
48 |
| 1073/ 3 |
M |
48 |
BLOKIRANA ©® |
<1 |
/ |
A I T 2 |
20 |
| 1111/ 3 |
Z |
48 |
/ |
/ |
/<1 |
A I T 2 |
24 |
| 1324/ 3 |
M |
50 |
/ |
/ |
6 |
A I T 2 |
36 |
| 36 |
M |
63 |
/ |
/ |
/2 |
A I T 2 |
28 |
| 444/ 3 |
M |
40 |
BLOKIRANA ©® |
<1/ |
/ |
A I T 2 |
24 |
| 478/ 3 |
Z |
31 |
BLOKIRANA ©® |
<1 |
/ |
A I T 2 |
6 |
| 71 |
M |
56 |
MIBI-NORMALNA ©® |
/ |
10/3.5 |
S K H I P O |
18 |
| 80 |
M |
59 |
MIBI-BLOKIRANA ©® |
<1 |
/1.5 |
A I T 2 |
30 |
| 98 |
M |
51 |
MIBI-NORMALNA ©® |
/ |
/ |
A I T 2 |
12 |
| 205 |
Z |
59 |
BLOKIRANA ©® |
<1 |
/ |
A I T 2 |
24 |
| 142 |
M |
48 |
/ |
/ |
3 |
A I T 2 |
24 |
| 206 |
Z |
65 |
PN-FUNKCIJSKI |
/ |
/ |
E U |
36 |
| 101 |
Z |
66 |
/ |
/ |
7 |
E U |
60 |
| 1138/ 3 |
Z |
71 |
BLOKIRANA ©® |
<1 |
/ |
E U |
60 |
| 13 |
Z |
39 |
BLOKIRANA ©® |
<1 |
/ |
E U |
1 |
| 14 |
M |
51 |
BLOKIRANA ©® |
<1 |
/ |
E U |
4 |
| 16 |
Z |
46 |
BLOKIRANA ©® |
1 |
/ |
E U |
1 |
| 17 |
M |
45 |
/ |
/ |
4/3 |
E U |
36 |
| 21 |
Z |
54 |
BLOKIRANA ©® |
<1 |
/ |
E U |
3 |
| 23 |
M |
60 |
/ |
/ |
24/34 |
E U |
3 |
| 252/3 |
Z |
45 |
TOPLI MIKRONODUS |
/ |
/ |
E U |
2 |
| 33 |
Z |
29 |
/ |
/ |
3/6 |
E U |
6 |
| 34 |
Z |
63 |
BLOKIRANA ©® |
<1 |
/ |
E U |
16 |
| 35 |
M |
35 |
BLOKIRANA ©® |
<1 |
/ |
E U |
3 |
| 40 |
Z |
62 |
BLOKIRANA ©® |
<1 |
/ |
E U |
36 |
| 42 |
Z |
44 |
/ |
/ |
/2 |
E U |
12 |
| 63 |
M |
63 |
MIBI-BLOKIRANA ©® |
/ |
/ |
E U |
8 |
| 67 |
Z |
66 |
BLOKIRANA ©® |
<1 |
/ |
E U |
2 |
| 76 |
M |
48 |
BLOKIRANA ©® |
<1 |
/ |
E U |
120 |
| 93 |
M |
64 |
MIBI-BLOKIRANA ©® |
/ |
/ |
E U |
2 |
| 95 |
M |
63 |
MIBI-BLOKIRANA ©® |
/ |
/ |
E U |
6 |
| 194 |
Z |
45 |
NORMALNA ©® |
/ |
/ |
S K H I P E R |
10 |
| 193 |
M |
70 |
BLOKIRANA ©® |
<1 |
/ |
S K H I P E R |
4 |
| 176 |
M |
69 |
BLOKIRANA ©® |
<1 |
/ |
S K H I P E R |
12 |
| 166 |
Z |
56 |
BLOKIRANA ©® |
<1 |
/ |
S K H I P E R |
0.3 |
| 66 |
Z |
48 |
NORMALNA ©® |
/ |
/ |
S K H I P E R |
12 |
| 94 |
Z |
41 |
MIBI-BLOKIRANA ©® |
/ |
/ |
S K H I P E R |
10 |
|
|
| |
|
|
| |
|
|
| |
DISKUSIJA
Akumulaciju jodida u ©® stimuli¹e TSH, glavni regulator sveukupne
tireoidne funkcije. Drugi glavni faktor regulisanja aktivnosti NIS u ©® je
sam jod. Transport joda je inhibisan vi¹kom joda i poveęan i stimulisan
jodnim deficitom nezavisno od TSH 7.
Uticaj joda na sintezu TH zavisi od količine joda i trajanja primene joda.
Kada se primeni akutno u maloj ili umerenoj količini, jod izaziva male
promene u obimu organifikacije i praktično ne utiče na procenat fiksacije
radiojoda.
Veęe akutne doze joda izazivaju dvofazni odgovor u veličini organifikacije.
Najpre nastaje porast, a zatim smanjenje organskog vezivanja joda. Wolff i
Chaikoff su 1948. godine objavili da je organsko vezivanje jodida u ©®
pacova bilo blokirano kada je nivo jodida u plazmi dostigao kritično visok
prag. Ovaj fenomen poznat je kao akutni Wolff-Chaikoff-ljev efekat. Oko
dva dana kasnije, u prisustvu neprekidno visokih koncentracija jodida u
plazmi, dolazi do "bega" od, ili adaptacije na akutni efekat koji je
primeęen, tako da se ponovno uspostavlja organifikacija i normalna
biosinteza TH. Mehanizam koji je odgovoran za akutni Wolff-Chaikoff-ljev
efekat jo¹ nije rasvetljen. Smatra se da je adaptacija na akutni Wolff-Chaikoff-ljev
efekat posledica smanjenja transporta jodida u tireocit, ¹to dovodi do
dovoljno niske intraclularne koncentracije jodida, koja uklanja inhibiciju
organifikacije. Smanjenje transporta jodida koje omoguęava adaptaciju,
smanjuje brzinu tireoidnog klirensa jodida i fiksaciju radiojoda. Uprkos
tome, količina joda koja je akumulirana i organifikovana veęa je nego
normalno, mada brzina sekrecije T4 nije poveęana. Stoga, tokom produ¾ene
primene joda ©® stvara i oslobaša nekalorigene oblike joda. Verovatno je
najveęi deo joda koji se gubi iz ©® na ovaj način u obliku jodida - kod
zdravih osoba količina curenja joda je u direktnoj srazmeri sa unosom joda
8.
Našeno je da pacijenti koji uzimaju 300 mg AMD na dan imaju 40 puta veęu
urinarnu ekskreciju neorganskog joda i četrdeset puta veęu koncentraciju
neorganskog joda u plazmi, dok je tireoidni uptake smanjen za 75%, a
tireoidni klirens jodida smanjen sa 6 ml/min na 0.5 ml/min 1-4.
Saller i sar. pored visokog poveęanja serumske koncentracije neorganskog
joda kod pacijenata na terapiji sa AMD, ne nalaze da su one u korelaciji
sa dnevnom dozom AMD, niti sa serumskom nivoom AMD 9.
Brojni inhibitorni mehanizmi, kao ¹to je veę pomenuto, ¹tite organizam od
prekomernog stvaranja tireoidnih hormona usled optereęenja egzogenim
jodom. Jod inhibi¹e sopstvenu organifikaciju (Wolff-Chaikoff-ljev efekat)
i smanjuje tireoidni klirens joda. Mešutim, kada se uzme u obzir apsolutno
preuzimanje joda, uočeno je da nakon ¹est nedelja lečenja sa AMD dolazi do
trostrukog porasta ove vrednosti, nakon čega dolazi do njegovog
progresivnog pada, ali on i dalje ostaje vi¹i od normalnog 4.
Pretpostavljeni mehanizam nastanka amiodaronom indukovanog hipotiroidizma
(AIH) je perzistentna blokada organifikacije joda izazvana vi¹kom
joda; nakon akutne inhibicije sinteze - akutni Wolff-Chaikoff-ljev efekat,
dolazi do ponovnog uspostavljanja prethodnog nivoa sinteze tiroidnih
hormona (TH) - fenomen bega, ¹to je posledica autoregulatornog mehanizma
smanjenog transporta joda u tireocite. Kod pacijenata koji razvijaju
hipotiroidizam ne dolazi do fenomena bega i sinteza hormona ostaje trajno
inhibisana hroničnim unosom vi¹ka joda.
Dokaz za ovakvo dogašanje kod AIH je:
- očuvana rana fiksacija 131I i 99mTcO4-
u ©® ,
- pozitivan perhloratski test i
- nizak intratireoidni sadr¾aj joda, ¹to je odlika i klasičnog jodom
indukovanog hipotiroidizma (IIH).
Postoje dva tipa amiodaronom indukovane tirotoksikoze (AIT). AIT tip
l se javlja kod pacijenata sa prethodnom tireoidnom bole¹ęu kao ¹to su
polinodozna, nodozna ili difuzna struma. Supklinički autonomno tkivo ©®
poveęava sintezu hormona u odgovoru na hronično optereęenje jodom iz AMD.
Prethodan deficit joda stvara uslove za razvoj autonomnih tireoidnih
nodusa, a sledstvena primena joda vodi ka autonomnom prekomernom stvaranju
TH od strane ovih nodusa - fenomen poznat kao Jod-Basedow (jodom
indukovana tireotoksikoza - IIT). Unger i sar. ovu hipotezu o nastanku AIT
nazivaju metabolička hipoteza
Kod pacijenata sa Graves-ovom bole¹ęu autonomija ©® kao posledica
autoimune stimulacije obja¹njava jodom indukovanu tireotoksikozu. Odlike
tipa 1 AIT su:
- normalna ili povi¹ena vrednost fiksacije radiojoda,
- normalna ili lako povi¹ena vrednost serumskog IL-6 i
- karakterističan ultrazvučni nalaz sa nodoznim ili difuzno
hipoehogenim obrascem.
AIT tip 2 se javlja kao posledica direktnog citotoksičnog efekta
amiodarona kod pacijenata sa normalnom ©®. AMD kod ovih pacijenata izaziva
subakutni destruktivni tiroidit sa sledstvenim oslobašanjem veę stvorenih
hormona u cirkulaciju. Takoše, iz o¹teęenih tireoidnih ęelija se verovatno
oslobaša i IL-6:
- fiksacija radiojoda je niska ili odsutna,
- serumski IL-6 je izrazito povi¹en,
- ultrazvučni nalaz ©® je normalan.
Uprkos velikom unosu joda, fiksacija 131I/99mTcO4-
je detektabilna kod pacijenata sa AIH bez obzira na prisustvo ili odsustvo
prethodne bolesti ©®. Prema istra¾ivanju Ungera i sar., RAIU, kod
pacijenata sa AIH dosti¾e maksimum nakon 2 sata i ostaje nepromenjen do 24
sata. Rana fiksacija (do 7 sati) je normalna zbog izostanka inhibicije
mehanizma za koncentraciju joda, a niska fiksacija za 24 h se obja¹njava
smanjenom organifikacijom joda 10. Nalazi RAIU i scintigrafije
©® kod na¹a dva pacijenta sa AIH takoše pokazuju očuvanu ranu akumulaciju
obele¾ivača, ¹to je slučaj i sa jednim supklinički hipotireoidnim
pacijentom.
Suprotno ovome, kod pacijenata sa AIT, fiksacija 131I je
normalna ili čak poveęana kod onih sa prethodnom bole¹ęu ©®, dok je vrlo
niska kod onih sa normalnom ©® 11. Scintigrafija mo¾e ukazati
na prisustvo regionalne autonomije. Tri na¹a pacijenta sa AIT imala su
očuvanu i pojačanu akumulaciju pertehnetata – dva pacijenta sa toksičnim
adenomom i pacijentkinja sa difuznom toksičnom strumom (M.Graves), prema
čemu su svrstani u AIT tip 1, i uspe¹no lečeni radiojodom, pacijenti sa
toksičnim adenomom, i medikamentnom tireosupresivnom terapijim,
pacijentkinja sa Graves-ovom bole¹ęu.. Preostali pacijenti sa AIT, njih
10, koji su imali “blokiranu” ©®, u skladu sa kliničkim ispoljavanjem,
svrstani su u AIT tip 2, koja se leči glukokortikoidima.
Fiksacija radiojoda je veoma niska kod eutireoidnih pacijenata na terapiji
sa AMD, bez obzira na prisustvo ili odsustvo strume.12-16 Od 17
na¹ih eutireoidnih pacijenata kojima je in vivo testirana ©® , svi sem
troje njih imalo je »blokiranu« ©®. Kod dvoje su prikazani funkcionalni
adenom, a jedan pacijent imao je normalan RAIU. Du¾ina terapije AMD nije
bila presudna za ovaj nalaz.
Varijacije u nalazima kod supklinički hipertireoidnih i nekih eutireodnih
pacijenata mo¾da bi se mogla objasniti velikim razlikama u biolo¹koj
raspolo¾ivosti AMD.
Ęelijski uptake 99mTc-MIBI-ja, katjonskog kompleksa, posledica
je kombinacije njegovog naelektrisanja i lipofilnosti sa visokim
negativnim membranskim potencijalom endomitohondrijalno, ¹to uslovljava
njegovu retenciju u mitohondrijama, koja nije organ specifična. Obele¾ivač
se ne zadr¾ava u ireverzibilno ishemičnim ęelijama, ¹to ga čini osetljivim
markerom ęelijske vijabilnosti. 99mTc-MIBI obezbešuje
kvalitetne scintigrafije ¹titaste ¾lezde (©®). Za razliku od joda ili
pertehnetata, izgleda da TSH, kao i vi¹ak joda, ne utiču na akumulaciju
MIBI-ja u ©®.17
Moguęi uzroci slabe vizualizacije ©® sa 99mTc-MIBI kod na¹ih
pacijenata mogli bi biti sledeęi:
- Tehnički - radiofarmak, parametri akvizicije (malo verovatno)
- Patolo¹ki proces u ©® – difuzna destrukacija tirocita (posledica
citotoksičnosti AMD i/ili samog joda) sa ili bez kliničke i/ili
biohemijske tiroidne disfunkcije
- Optereęenje jodom (ne bi trebalo da utiče na akumulaciju MIBI u ©®)
- Za sada nepoznati razlozi
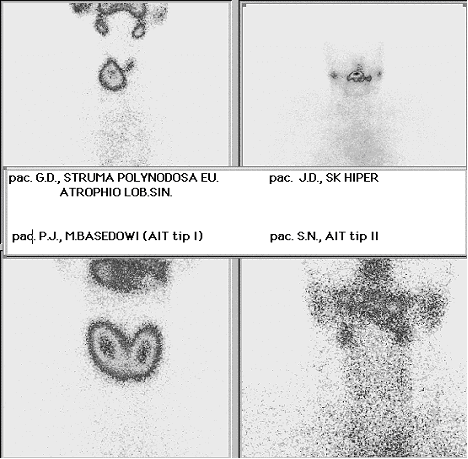
Slika 1. Scintigrafija ¹titaste ¾lezde tehnecijum pertehnetatom
kod pacijenata na terapiji sa AMD.
Slika levo gore – funkcionalni adenomi desnog re¾nja;
slika desno gore i desno dole – “blokirana” ©®;
Levo dole – difuzna toksična struma.
|
|
| |
 |
 |
|
| |
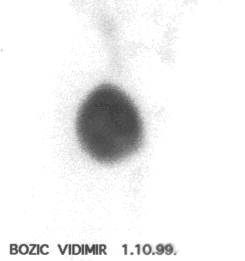
Slika 2.
Scintigrafija ¹titaste ¾lezde tehnecijum-pertehnetatom. Dekompenzovani
toksični adenom kod pacijenta (476/4) na hroničnoj terapiji amiodaronom.
Uočljiv očuvan uptake obele¾ivača uprkos hroničnog optereęenja jodom. |
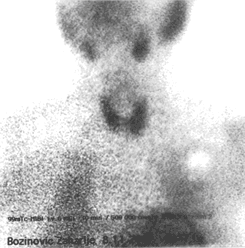
Slika 3.
Scintigrafija ©® sa 99mTc-MIBI kod pacijenta (71) starog 56
godina, na AMD terapiji 22 meseca, SK HIPOtiroidnog. Akvizicija rašena 30
minuta nakon i.v. aplikacije 6 mCi 99mTcMIBI |
|
| |
|
|
| |
|
|
| |
ZAKLJUČAK
In vivo tireoidni testovi, scintigrafija ©® tehnecijum pertehnetatpm,
test akumulacije pertehnetata i test radiojodne fiksacije mogu imati
klinički značaj u kombinaciji sa ostalim in vitro i in vivo testovima u
diferencijalnoj dijagnozi tipova amiodaronom indukovane tireotoksikoze,
čije je razlikovanje bitno za izbor adekvatne terapije. |
|
| |
|
|
| |
|
|
| |
LITERATURA
- Unger J, Lambert M.. Jonckheer M.H, et al. Amiodarone and thyroid:
pharmacological, toxic and therapeutic effects. J Intern Med 1993; 233:
435-443
- Nademanee K, Piwonka R, Singh B, et al. Amiodarone and thyroid. Prog
Cardiovas Disease 1989; 31(6): 427-437
- Davies PH, Franklyn JA. The effects of drugs on tests of thyroid
function. Eur J Clin Pharnacol, 1991; 40: 439-451
- Rao HR, Cready RV, Spathis SG. Iodine kinetic studies during
amiodarone treatment. J Clin Endocrinol Metab. 1986; 62: 563-567
- Dohan O, De la Vieja A, Carrasco N. Molecular study of the sodium-iodide
symporter (NIS): A new field in thyroidology. Trends in Endocrinology
and Metabolisam 2000; 11: 99-105
- Paunkovię N, Paunkovię J, Pavlovic O. Procena autoimune stimulacije
¹titaste ¾lezde testom akumulacije 99mTc-pertehnetata. Radiologia
Iugoslavica 1991; 25: 43-46
- Utiger RD and Burrow NG. Thyroid disease. In: Endocrinology and
metabolism. Graw Ed. Hill inc, 1995. 433-553.
- Larsen RP, Sidney IH. The thyroid gland. In: Williams textbook of
endocrinology. Wilson JD Ed. Saunders Co., Philadelphia, 1992. 360-378.
- Saller B, Fink H, Mann K. Kinetics of acute and chronic iodine
excess. Exp Clin Endocrinol Diabetes 1998; 106 suppl 3: 34-38
- Unger J, Surmont DW, Sarot J et al. 24 h-kinetics of iodide uptake
in amiodarone induced hypothyroidism. Thyroidology 1989; 1 (2): 101-2
- Martino E, Aghini-Lombardi F, Lippi F et al. Twenty-four hour
radioactive iodine uptake in 35 patients with amiodarone associated
thyrotoxicosis. J Nucl Med 1985; 26 (12): 1402-7
- Wiersinga W, Touber J, Trip M. et al. Uninhibited thyroidal uptake
of tadioiodine despite iodine excess in amiodarone-induced
hypothyroidism. J Clin Endocrinol Metab 1986; 63: 485-491
- Fragu P, Schlumberger M, Davy JM et al. Effects of amiodarone
therapy on thyroid iodine content as measured by X-ray fluorescence. J
Clin Endocrinol Metab, 1988; 66: 762-769
- Figge H, Figge J. The effects of amiodarone on thyroid hormone
function: a review of the physiology and clinical manifestations. J Clin
Pharmacol 1990; 30: 588-595
- Martino E, Bartalena L, Mariotti S et al. Radioactive iodine thyroid
uptake in patients with amiodarone-iodine-induced thyroid dysfunction.
Acta Endocrinol (Copenh) 1988; 119: 167-173
- Ross DS. Syndromes of thyrotoxicosis with low radioactive iodine
uptake. Endocrinol Metab Clin North Am 1998; 27(1): 169-85
- Helal BO, Delbot T, Rolland C et al. Tc-99m-sestamibi imaging of
suppressed thyroid tissue in hyperthyroid patients. Endocrine Journal
2000; 47 (suppl.): 178
|
|
| |
|
|
| |
Adresa autora:
®eljka Aleksię
Zdravstveni centar Zaječar, Slu¾ba za nuklearnu medicinu
Rasadnička B.B, 19000 Zaječar,
e-mail: lukaal@ptt.yu
Rad primljen 10. 08. 2004.
Rad prihvaęen 26. 08. 2004.
Elektronska verzija objavljena 18. 09. 2004. |
|
| |
|
|
|
|
|
|
|
|
|
[ Home ] [ Gore/Up ][ <<< ] [ >>> ]
|
|
|
Infotrend
Crea(c)tive Design |
|
|
|
Revised:
20 May 2009
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|



