| |
|
|
UVOD
Prevalenca kardiovaskularnih bolesti (cardiovascular disease –
CVD) u opštoj populaciji (7–20%) je značajno veća od prevalence
bubrežnih oboljenja (5–11%), iako se njihova učestalost značajno
povećava sa starenjem [1]. Prevalenca hroničnih bubrežnih bolesti
(chronic kidney disease – CKD Iº-Vº) nije ujednačena po stadijumima:
Iº (3,3%), IIº (3,0%), IIIº (4,3%), a IVº i Vº po 0,2% [2].
Udružena pojava kardiovaskularnih poremećaja i bubrežnih oboljenja
se ranije jednostavno označavala „komplikacijom prirodnog toka”
osnovnog (srčanog ili bubrežnog) oboljenja. Poslednju deceniju su
obeležila nastojanja timskih ekspertskih grupa da takva uzajamno
povezana stanja, označe kao poseban klinički entitet –
kardiorenalni/renokardijalni sindrom (cardiorenal/renocardiac
syndrome – CRS/RCS) [3].
Kardiovaskularni poremećaji (srčana insuficijencija, ishemijska
bolest, aritmije, naprasna srčana smrt i dr.) u sklopu hronične
progresivne nefropatije (CRS tip IV) najčešći su uzroci smrti
(46–60%) kod bolesnika lečenih dijalizom, što je 10–20 puta češće
nego u opštoj populaciji [2, 4].
Prema podacima iz Američkog registra bubrežnih bolesnika (United
States Renal Data System – USRDS), učestalost pojedinih CVD kod
bolesnika sa CKD je 3–5 puta veća nego u opštoj populaciji. Veća
učestalost i po pravilu brži i nepovoljniji klinički tok CVD
odgovorni su za veći broj rehospitalizacija i povećan smrtni ishod,
posebno kod osoba starijih od 65 godina [5].
PATOFIZIOLOGIJA
Uremijska kardiomiopatija (uremic cardiomyopathy – UCM) označava
patoanatomski supstrat koji predstavlja skup maladaptivnih promena
građe i strukture/geometrije preoblikovanog miokarda u uslovima
uremijske sredine, kao odgovor na hemodinamski stres pokrenut:
a) pojačanim srčanim radom usmerenim na savladavanje otpora
istiskivanju krvi, sistolno opterećenje pritiskom ili afterload
(sistemska arterijska hipertenzija, aortna stenoza, povećan otpor u
sistemskoj cirkulaciji, ...);
b) nesposobnošću leve komore da ostvari očekivani venski priliv bez
dodatnog povećanja intrakomorskog pritiska i/ili zapremine krvi na
kraju dijastole, dijastolno opterećenje zapreminom ili preload
(anemija, hronična hipervolemija, predimenzionirana A-V fistula,
aortna regurgitacija, hipertireoza i dr.) [6].
Komorskom preoblikovanju doprinose i drugi činioci koji su
manje-više zajednički za oba inicijalna mehanizma, a uglavnom su
vezani za uznapredovalu bubrežnu slabost i dijalizno razdoblje.
Aktivacija sistemskog i lokalnog renin-angiotenzin-aldosteron
sistema (RAAS), hiperadrenergička aktivnost, oksidativni stres i
proinflamatorni citokini [tumor necrosis factor-alpha (TNFα),
interleukin 6 (IL-6), interleukin 1 beta (IL-1β), C-reactive protein
(CRP)], pojačana ekspresija prohipertrofičkih [cardiotrophin-1,
transforming growth factor β (TGF-β)] i profibrotičkih [Fibroblast
growth factor 23 (FGF23)] činilaca doprinose strukturnom
rearanžiranju i malfunkciji miocita i miofibroblasta.
Hipovitaminoza kalcitriola (odsustvo inhibicije Bsm1 gen – povećanje
sarkomera) i efekti hiperapatireoidizma (FGF 23 – zavisna regulacija
rasta i diferencijacije miocita, hiperfosfatemija, povećan CaxP
proizvod, degradacioni produkti PTH) dovode do fibroznih promena i
odlaganja Ca-P depozita u srčanim strukturama i zidovima krvnih
sudova, što pogoduje progresiji oštećenja leve komore [7].
Komorsko preoblikovanje po pravilu pokrenuto arterijskom
hipertenzijom, označava se kao koncentrična hipertrofija leve komore
(concentric left ventricular hypertrophy - cLVH) i registruje se kod
75–80% bolesnika u momentu otpočinjanja lečenja dijalizom. Zbog
povećanog opterećenja zapreminom dolazi do nesrazmernog povećanja
njenih unutrašnjih dimenzija, što se uz očuvanu debljinu
pripadajućih zidova i još uvek povećanu masu leve komore (left
ventricular mass index - LVMI), označava kao ekscentrična
hipertrofija leve komore (eccentric left ventricular hypertrophy -
eLVH). Oba poremaćaja po strukturnim i funkcionalnim osobinama leve
komore (LV) predstavljaju patofiziološki supstrat njene dijastolne
disfunkcije (left ventricular diastolic dysfunction – LVDD) [7, 8].
Dijastolna srčana slabost/insuficijencija (diastolic heart failure –
DHF) označava funkcionalno stanje miokarda u kome postoji očuvana
ili granična ejekciona frakcija leve komore (left ventricular
ejection fraction – LVEF) i registruje se kod 50–65% bolesnika
lečenih dijalizom. Prema najnovijoj klasifikaciji Evropskog
kardiološkog društva (The European Society of cardiology – ESC) iz
2016. godine, u srčanu insuficijenciju sa očuvanom ejekcionom
frakcijom spadaju bolesnici čija je LVEF ≥50 (HFpEF), dok bolesnici
sa LVEF od 40–49% spadaju u granično ili područje „sive zone“
(HFmrEF) [9].
Dalje preoblikovanje uremijskog miokarda dešava se u odsustvu
kompenzatorne miocitne hipertrofije, pa funkcionalni sincicijum
zamenjuje hiperprodukcija kolagena i fibrozno tkivo. Debljina
pripadajućih zidova LV se smanjuje, a njena zapremina raste, što se
označava kao dilatacija leve komore (left ventricular dilatation –
LVD). Patoanatomski, to stanje predstavlja supstrat njene sistolne
disfunkcije (left ventricular systolic dysfunction - LVSD) i
predvorje kongestivne srčane slabosti (congestive heart failure –
CHF) koja se registruje kod oko 30% bolesnika na dijalizi [7, 10].
U funkcionalnom smislu, dijastolna disfunkcija označava smanjenu
komplijansu leve komore, usled čega je njena relaksacija usporena, a
dijastolno punjenje otežano. Zbog toga dolazi do povećanja
end-dijastolnog pritiska sa posledicama retrogradnih maladaptivnih
poremećaja na nivou leve pretkomore (left atrium – LA), odnosno
plućne kapilarne mreže i desnog srca. Sa pojavom simptoma i znakova
srčane slabosti, ovaj poremećaj evoluira u klinički sindrom
dijastolne srčane slabosti (diastolic heart failure – DHF) [11].
DIJAGNOZA
ESC preporučuje sledeće kriterijume za postavljanje dijagnoze
DHF:
- klinički simptomi i znaci sa normalnom/graničnom ejekcionom
frakcijom LV (EF > 50%);
- povećan završni dijastolni pritisak u LV (> 15 mmHg) izmeren
neposredno kateterizacijom ili posredno izvedena vrednost iz
ehokardiografskih (ECHO) parametara;
- odgovarajuće promene transmitralnog protoka (E/A; E/e' i
dr.);
- izmenjena geometrija leve pretkomore (LAVI > 28 ml/m2,
LADI,..) [12].
Dopunske dijagnostičke procedure (holter-EKG i 24-časovni
ambulatorni monitoring krvnog pritiska – AKMP), druge vizualizacione
procedure (MSCT, CMR) i biološki markeri srčane ishemije i
insuficijencije (cTn, BNP, NT-pro BNP) [13].
Etiološki i doprinoseći činioci: arterijska hipertenzija,
ishemijska bolest srca, ateroskleroza arterija srednjeg i velikog
kalibra, pretkomorska fibrilacija, dijabetes, gojaznost, metabolički
poremećaji, biološka starost i dr.
Simptomi i znaci srčane slabosti se mogu proceniti i
klasifikovati prema težini u skladu sa preporukama Njujorškog
kardiološkog udruženja (New York Heart Association – NYHA Functional
Classification) po pravilu objektivizirani opisom kliničkog nalaza
(A–D klasifikacija), mada su ovi kriterijumi upotrebljiviji kod
bolesnika sa CHF [14].
Budući da u uznapredovalim stadijumima CKD postoji stanje hronične
hipervolemije koja je u svojevrsnoj ravnoteži sa relativnom
poliurijom, kod bolesnika simptomi srčane slabosti obično ne
variraju značajnije, osim u stanjima terapijski indukovane
ekscesivne diureze, ili ultrafiltracije tokom hemodijalize. U takvim
prilikama subjektivni iskaz bolesnika o tegobama pre i nakon
hemodijalize se značajno razlikuje, pa se oni ne mogu pouzdano
svrstati u određenu NYHA funkcionalnu klasu. Neretko se nakon
dijalize, po subjektivnom iskazu, oni mogu vratiti za jednu ili dve
funkcionalne klase unazad, da bi se pred narednu hemodijalizu ponovo
samoregrutovali u pređašnje stanje više NYHA klase, pa se ta pojava
označava kao fenomen „plime i oseke". Takva saznanja su bila osnovni
povod da radna grupa na multidisciplinarnoj konferenciji o
unapređenju kvaliteta lečenja akutnom dijalizom – Acute Dialysis
Quality Initiative (ADQI) 2014. godine predloži modifikovani NYHA-R
klasifikacioni sistem, tabela 1 [15].
VIZUALIZACIONE TEHNIKE PREGLEDA
I Ehokardiografski kriterijumi DHF su pouzdani, lako
izvodljivi i reproducibilni parametri. Obično se standardna
(2D/MM/PW/CW) ehokardiografska snimanja rade tri meseca nakon
početka lečenja dijalizom, a zatim na 12-18 meseci. Merenja se
obavljaju u srednjem nedijaliznom danu u nedelji, najbolje od 12 do
18h, ali i uvek kod pojave novih simptoma ili kardiovaskularnih
događaja [16].
Na osnovu dogovorno utvrđenih kriterijuma ehokardiografske procene
geometrije leve pretkomore, transmitralnog i protoka u izlaznom
traktu LV, težina LVDD se prikazuje kao: smanjena relaksacija (Iº);
pseudonormalizacija (IIº) i restrikcija (IIIº), tabela 2 [18–20].
Tabela 1. Modifikovani NYHA-R kriterijumi prema ADQI
Table 1: Modificated NYHA-R criteria according to ADQI
| Funkcionalna klasa / Functional class |
Simptomi / Symptoms |
Prelazak u nižu funkcionalnu NYHA klasu nakon HD ili
HDF/
Transition to lower functional NYHA class after HD or HDF |
| I |
Asimptomatski bolesnici sa ECHO dokazima miokardnog
oštećenja
Asymptomatic patients with ECHO evidence of myocardial
damage |
Ne/No |
| II R |
Dispnea na napor koja se smanjuje nakon HD/UF
Dyspnea on exertion, which decreases after HD/UF |
Da/Yes |
| II NR |
Dispnea na napor koja se ne smanjuje nakon HD/UF
Dyspnea on exertion, which does not decrease after HD/UF |
Ne/No |
| III R |
Dispnea pri uobičajenoj dnevnoj aktivnosti koja se
smanjuje nakon HD/UF
Dyspnea during normal daily activity, which decreases after
HD/UF |
Da/Yes |
| III NR |
Dispnea pri uobičajenoj dnevnoj aktivnosti koja se ne
smanjuje nakon HD/UF
Dyspnea during normal daily activity, which does not
decrease after HD/UF |
Ne/No |
| IV R |
Dispnea u miru koja se smanjuje nakon HD/UF
Dyspnea at rest, which decreases after HD/UF |
Da/Yes |
| IV NR |
Dispnea u miru koja se ne smanjuje nakon HD/UF
Dyspnea at rest, which does not decrease after HD/UF |
Ne/No |
Tabela 2. Ehokardiografski kriterijumi za dijagnozu i procenu
težine LVDD
Table 2. Echocardiographic criteria for the diagnosis and assessment
of severity of LVDD
DIJASTOLNA DISFUNKCIJA LEVE
KOMORE
LEFT VENTRICULAR DIASTOLIC DYSFUNCTION |
LVMI > 131 g/m2(m)
LVMI > 100 g/m2 (f) |
E > 50% |
FS > 25% |
RPWT > 0,45 (≤ 0,45) |
SMANjENA RELAKSACIJA
REDUCED RELAXATION |
POVEĆANA RESTRIKCIJA
INCREASED RESTRICTION |
| E/A < 1 |
DTE > 250 ms |
E/A > 1,6 |
DTE < 150 ms |
PROCENA TEŽINE DIJASTOLNE
DISFUNKCIJE
ASSESSMENT OF THE SEVERITY OF DIASTOLIC DYSFUNCTION |
PARAMETAR
(normalan LAP/normal LAP) |
Iº smanjena relaksacija
(normalan LAP)
Iº Reduced relaxation (normal LAP) |
IIº pseudonormalizacija
(umereno povećan LAP)
IIº pseudonormalization (moderately increased LAP) |
IIIº restrikcija
(značajno povećan LAP)
IIIº restriction (significantly increased LAP) |
| E/A: 0,8–2,0 |
< 0,8 |
0,8–2,0 |
> 2,0 |
| DTE: 160–200 ms |
> 200 ms |
160–200 |
< 160 ms |
| IVRT: 80–100 ms |
> 100 |
60 –100 |
< 60 |
| e’: > 8 cm/s |
> 8 |
< 8 |
< 8 |
| E/e’ ≤ 8 |
≤ 8 |
9 - 12 |
> 13 |
| LAVI: 16–28 ml/m2 |
28 - 34 |
≥ 34 |
> 34 |
Legenda/legend: LVMI – indeks mase leve komore/left
ventricular mass index; m – muškarci/male; f – žene/female; E –
maksimalna brzina transmitralnog protoka u ranoj dijastoli/peak
velocity of early diastolic transmitral flow; FS – frakciono
skraćenje/fractional shortening; RPWT – relativno zadebljanje
zadnjeg zida LK/the relative thickening of the LV posterior wall;
E/A - relativni odnos rane i kasne maksimalne brzine transmitralnog
protoka/the relative ratio of early to late peak velocity of
transmiral flow; DTE – vreme deceleracije talasa E/deceleration time
of E wave; LAP – pritisak u levoj pretkomori/left atrial pressure;
IVRT – vreme izovolumetrijske relaksacije/isovolumetric relaxation
time; e’ – brzina pokreta mitralnog prstena u protodijastoli/ early
diastolic mitral annular velocity; E/e’ – odnos E prema e'/ratio of
E to e'; LAVI – indeks zapremine leve pretkomore/left atrial volume
index;
Ehokardiografski parametri: za 2D, MM i pulsni dopler (PW) se
dobijaju standardnim pozicioniranjem ultrazvučne sonde u
parasternalni uzdužni i poprečni presek, kao i apikalni položaj sa 4
i 5 šupljina, slike 1 i 2.
Većina parametra se automatski izračunava ugrađenim programskim
softverom, mada postoje i oni za koje je potrebno naknadno računanje
ili indeksiranje prema telesnoj površini (BSA/m2) [19, 17, 21].
Slika 1. 2D/MM ehokardiografski prikaz: Leva
komora
Figure 1. 2D/MM echokardiography image: Left ventricle
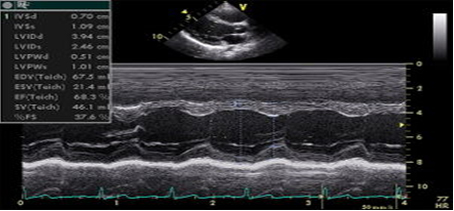
LVEDD = završna dijastolna dimenzija leve komore/ left ventricular
end diastolic diameter
IVSd = debljina međukomorskog septuma u dijastoli/ interventricular
septum thickness at end-diastole
LVPWd = debljina zadnjeg zida LK u dijastoli/ Left ventricular
posterior wall thickness at end –diastole
BSA = telesna površina/ body surface area
LVMi = 0.8 x {1.04 x [LVEDD + IVSd + LVPWd]3 - LVEDD3]} + 0.6 } :
BSA (g/m2)
RPWT = (2 x LVPWd) : LVEDD
Slika 2. 2D ehokardiografski prikaz: Leva pretkomora
Figure 2. 2D echokardiography image: Left atrium
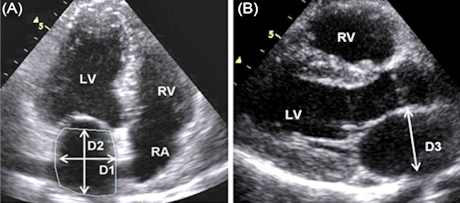
LAD = dijametri leve pretkomore/left atrial diameters: D1, D2, D3
LAVI = LAV/BSA = (D1 x D2 x D3) x 0,523/BSA = 16 –28 ml/m2
MR VMax = maksimalna brzina mlaza mitralne regurgitacije/peak
velocity of the mitral regurgitant jet
SBP = sistolni krvni pritisak/systolic blood pressure
LAP = pritisak u levoj pretkomori/left atrial pressure: SBP - 4 (MR
VMax)2 ≤ 12 mmHg
W dopler parametri (standardni + TDI) – transmitralni protok: kada
je to moguće, standardni ECHO pregled treba dopuniti i parametrima
tkivnog doplera (TDI), kojima se bolje prikazuju strukture manje
amplitude pokretljivosti i objektivnije vrednuje segmentni prikaz
pokreta srčanih struktura, slika 3 [17].
Slika 3. PW dopler parametri (standardni + TDI): transmitralni
protok
Figure 3. PW Doppler parameters (standard + TDI): transmitral flow
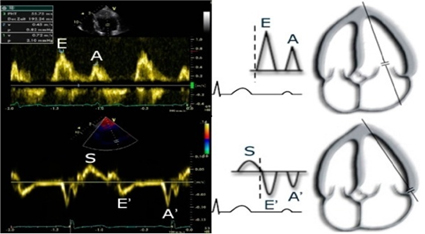
EMAX - maksimalna brzina ranog dijastolnog
punjenja LK/ peak velocity of early diastolic filling of LV: 0,8 ±
0,2 m/s (PW)
AMAX - maksimalna brzina završnog dijastolnog punjenja LK/ peak
velocity of late diastolic filling of LV: 0,5 ± 0,2 m/s (PW)
E/A odnos/ratio: 0,8 - 2,0
es’ – septalna brzina pokreta mitralnog prstena u ranoj dijastoli/
septal velocity of early diastolic mitral annular motion: > 8 cm/s
(TDI)
E/es’ odnos/ratio: ≤ 8
LAP - pritisak u levoj pretkomori/ left atrial pressure: 1.9 + 1.24
× E/es’ ≤ 12 mmHg
Vremenski intervali komorske dijastole na posredan način
reflektuju sposobnost komorskog miokarda da bez dodatnog povećanja
endokavitarnog pritiska prihvati priliv krvi iz LA, što se
reflektuje na morfologiji talasa E, odnosno njegovog nagiba (DTE)
(slika 4). Osim toga, dijastolna disfunkcija leve komore odražava se
na dužinu vremenskog intervala koji se odnosi na period od
zatvaranja aortnog do otvaranja mitralnog zaliska – izovolumetrijska
relaksacija (IVRT), (slika 5).
Slika 4. Vremenski intervali komorske dijastole
Figure 4. Time intervals of ventricular diastole
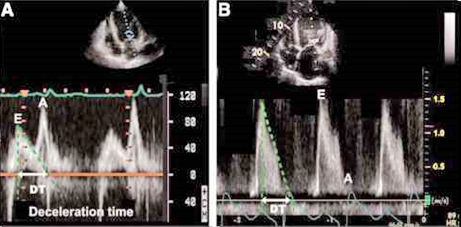
DTE - vreme deceleracije talasa E/ deceleration
time of mitral E wave: 180 ± 20 ms (PW)
Slika 5. - Vreme izovolumetrijske relaksacije
Figure 5. Isovolumetric relaxation time
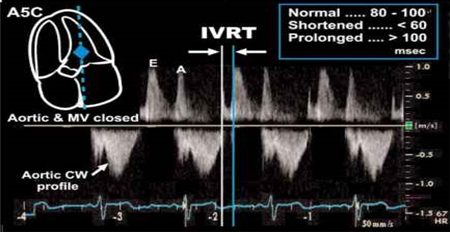
IVRT – vreme izovolumetrijske relaksacije leve
komore/ isovolumetric relaxation time of LV: 80-100 ms (CW/TDI)
II. Kardiovaskularna magnetna rezonanca (CMR) predstavlja
objektivni, neinvazivni pregled kojim se primenom gadolinijuma može
dokazati prisustvo miokardne fibroze, ali i sam radiofarmak ima
profibrotični efekat, pa nije od koristi kod značajnije oštećene
funkcije bubrega [22].
BIOLOŠKI MARKERI MIOKARDNOG OŠTEĆENJA
Standardna upotreba biomarkera srčane slabosti [komorski
natriuretski peptidi (BNP i NT-proBNP)] i miokardne ishemije (CK-MB,
cTnI/cTnT) kod bolesnika sa bubrežnom slabošću, ograničena je
činjenicom da njihove serumske koncentracije zavise od jačine
glomerulske filtracije. Zbog toga se povišene serumske vrednosti
moraju tumačiti na način prikazan u tabeli 3 [23, 24].
Budući da se povišene serumske vrednosti mogu registrovati i mimo
akutnog ishemijskog događaja ili srčane slabosti (atrijalna
fibrilacija, hipertenzija, plućni tromboembolizam i dr.),
preporučuje se praćenje dinamičkih promena njihovim ponavljanim
merenjima na 3-6h, kao i u graničnim slučajevima u opštoj
populaciji.
Tabela 3. – Biološki markeri miokardnog oštećenja
Table 3. Biological markers of myocardial damage
| GFR (ml/min) |
HF or ACS |
BNP
(pg/mL) |
NT-proBNP
(pg/mL) |
CK
(IU/L) |
MB-CK
(IU//L) |
Hs cTnI
(ng/mL) |
Hs cTnT
(ng/mL) |
| 90-120 |
Ne ili nesigurno/
No or unlikely |
<100 |
<250 |
24 –190 m
24-170 f |
<25 |
<0.040 |
<0.014- 0.052 |
| ≥60 |
Verovatno/
Likely |
100-200 |
>450 |
<336 m
<176 f |
>50 |
>0.040 |
>0.053 |
| <60 |
Verovatno/
Likely |
>200 |
>1200 |
>336 m
>176 f |
>100 |
>0.60? |
>0.100? |
| ESRD |
Verovatno/
Likely |
>400 |
>7200 |
>400 m
>200 f |
>200 |
>1.00? |
1.0-10.0? |
Legenda/legend: GFR – jačina glomerulske
filtracije/glomerular filtration rate; HF – srčana
insuficijencija/heart failure; ACS – akutni koronarni sindrom/acute
coronary syndrome; m – muškarci/male; f – žene/female; ESRD –
završni stadijum hronične bolesti bubrega/end stage renal disease
PREVENCIJA I LEČENJE
Pravovremena dijagnoza se zasniva, najpre, na pažljivoj analizi
anamnestičkih podataka o tegobama koje često mogu biti nespecifične
i "objašnjive drugim pratećim poremećajima" koji su sastavni deo
prirodnog toka CKD. Osim toga, životna dob i podaci o višegodišnjoj
hipertenziji, ishemijskoj bolesti srca, srčanim aritmijama,
dijabetesu, gojaznosti, sekundarnom hiperparatireoidizmu (SHPT),
perikaraditisu i drugo, često mogu biti od koristi za otkrivanje
doprinosećih činilaca [22, 25, 26].
Preventivne mere treba da obezbede korekciju doprinosećih
činilaca za nastanak i održavanje CHF:
- smanjiti telesnu masu kod gojaznih bolesnika (BMI): 25– 30
kg/m2;
- održavati krvni pritisak na vrednostima 130-140/80– 85 mmHg;
- redukcija unosa soli na ≤ 2g/d;
- antihipertenzivi – prema preporukama;
- medikamentna i/ili hirurška kontrola SHPT tako da serumski
iPTH bude 150-300 pg/ml, a serumski fosfat i kalcijum (Ca:
2,10–2,37 mmol/L; P: 1,13–1,78 mmol/L) takvi da C a x P proizvod
bude manji od 4,4 mmol2/L2;
- kontrola dijabetesa: HbA1C < 7%;
- korekcija anemije: Hgb: 110–120 g/L;
- kontrola nutritivnog, prooksidantnog i proinflamatornog
stausa: homocistein < 15 μmol/l; CRP<10 mg/l; a serumski albumin
i lipidni status u skladu sa važećim preporukama.
- optimizacija hemodijalize:
vantelesna hemodijaliza: Kt/V ≥1.2
peritoneumska hemodijaliza: 1.7–2.2
kvalitet vode za hemodijalizu: bakterija (0–100 CFU/ml);
endotoksin: (0–0.25 EU/ml)
jačina protoka kroz A-V fistulu: 500–1000 ml/min;
- interdijalitički porast telesne težine: 3-5% "idealne/suve"
telesne mase.
Medikamentno lečenje CHF podrazumeva primenu terapije koja
treba da obezbedi:
- bolju komorsku relaksaciju: ACEI, ARBs, Ca-antagonisti;
- regresiju hipertrofične leve komore: ACEI, ARBs, β-blokatori
(carvedilol, metoprolol, bisoprolol, nebivolol), Ca-antagonisti,
antagonisti aldosterona, cholecalcipherol, 1,25
dihidrocholecaplcipherol, torasemid [27];
- održivu kontrolu sinusnog ritma i kontrolu tahikardije /
tahiarimije: β-blokatori, Ca-antagonisti - 2º generacija,
amyodarone, antiagregacioni i/ili antikoagulantni lekovi,
interventne procedure (kardioverzija, radiofrekventna ablacija);
- kontrolu ishemijske bolesti srca: medikamentna [nitrati
(isosorbid mono-/dinitrat), β-blokatori (atenolol, metoprolol),
Ca-antagonisti (diltiazem, verapamil)] i/ili revaskularizaciona
terapija (PCI, by-pass grafting).
Izbor dijalizne metode treba da obezbedi adekvatnu
dijalizu i ultrafiltraciju, bez naglih promena zapremine cirkulišuće
tečnosti i krvnog pritiska. Nadoknada tečnosti tokom dijalize ili u
interdijaliznom razdoblju mora biti obazrivo i pažljivo proračunata
zbog mogućnosti akutne plućne kongestije kod uznapredovale
dijastolne disfunkcije (gr. IIIº).
Intermitentna hemodijaliza (IHD) sa bikarbonatnim puferom i
biokompatibilnom membranom dovoljno visokog konvektivnog transporta
(Kuf 5–10 ml/h/mmHg) je efikasan, najdostupniji i najčešće korišćeni
način lečenja bolesnika sa hipervolemijom. Intenzivnu
ultrafiltraciju treba izbegavati, posebno kod normo/hipotenzivnih
bolesnika, osim u stanjima akutne levostrane srčane slabosti (edem
pluća).
Kontinuirani manuelni i automatski modaliteti peritoneumske dijalize
mogu biti od koristi zbog uravnotežene i neekscesivne
ultrafiltracije, bolje kontrole hipertenzije, anemije, SHPT i dužeg
održavanja rezidualne diureze [7].
ZAKLJUČAK
Kardiovaskularne bolesti su visoko zastupljene u završnom
stadijumu hronične bubrežne slabosti i praćene su komplikacijama
koje rezultiraju učestalim hospitalizacijama, a opterećene su i
dalje zabrinjavajuće ozbiljnim rizikom nepovoljnog ishoda.
Dijastolna srčana insuficijencija je klinički sindrom
karakterističan za bolesnike na hemodijalizi, koji se nadovezuje na
postojeće kardiovaskularne bolesti i dalje razvija zahvaljujući
brojnim doprinosećim činiocima. Stoga je vrlo važno pravovremeno
postaviti dijagnozu, pridržavajući se, pre svega, kliničkih
kriterijuma koji su prilagodjeni specifičnostima dijaliznih
bolesnika, kao i ehokardiografskih kriterijuma za dijagnozu
disfunkcije leve komore. Preventivne strategije sa ciljem kontrole
doprinosećih činilaca, medikamentna terapija kardiovaskularnih
bolesti odgovornih za razvoj kongestivne srčane insuficijencije,
racionalni izbor dijaliznog modaliteta u odnosu na kardiovaskularni
status bolesnika i sprovodjenje adekvatne dijalizne procedure su
postupci od kojih možemo očekivati poboljšanje kliničkog toka i
ishoda kod dijaliznih bolesnika.
LITERATURA
- Kannel WB. Incidence and epidemiology of heart failure.
Heart Fail Rev 2000; 5(2): 167-173.
- Tonelli M, Wiebe N, Culleton B, House A, Rabbat C, et al.
Chronic kidney disease and mortality risk: A systematic review.
J Am Soc Nephrol 2006; 17: 2034–2047.
- Poskurica M. Kardio-renalni sindrom: definicija,
etiopatogeneza, klinička slika, dijagnostika, preventiva i
lečenje. U: Akutna bubrežna insuficijencija: preventiva,
dijagnostika i lečenje. Poskurica M. Ed. Medicinski fakultet
Kragujevac, Inter print Kragujevac, Kragujevac 2009; p.40-48.
- Di Lullo L, Gorini A, Russo D, Santoboni A, Ronco C. Left
Ventricular Hypertrophy in Chronic Kidney Disease Patients: From
Pathophysiology to Treatment. Cardiorenal Med 2015; 5: 254–266.
- Epidemiology of Kidney Disease in The United States. United
States Renal Data System (USRDS). Annual Data Report 2016.
Available from:
https://catalog.data.gov/dataset/usrds-annual-data-report.
- Paoletti E, Cannella G. Arterial hypertension and left
ventricular hypertrophy in hemodialysis patients. Clin Nephrol
2002; 58 Suppl 1: S46-51.
- Poskurica M, Petrović D. Zastojna srčana insuficijencija kod
bolesnika sa oštećenom funkcijom bubrega. Srp Arh Celok Lek
2014; 142 (11-12): 747-755.
- Ritz Е. Left ventricular hypertrophy in renal disease:
beyond preload and afterload. Kidney International 2009; 75:
771–773.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats
AJ, et al. 2016 ESC Guidelines for the diagnosis and treatment
of acute and chronic heart failure: The Task Force for the
diagnosis and treatment of acute and chronic heart failure of
the European Society of Cardiology (ESC)Developed with the
special contribution of the Heart Failure Association (HFA) of
the ESC. Eur Heart J 2016; 37(27): 2129-2200.
- Levin A, Foley RN. Cardiovascular disease in chronic renal
insufficiency. Am J Kidney Dis 2000; 36: S 24-30.
- Borlaug BA. The pathophysiology of heart failure with
preserved ejection fraction. Nature Reviews Cardiology 2014; 11:
507–515.
- Rossi A, Gheorghiade M, Triposkiadis F, Solomon SD, Pieske
B, Butler J. Left Atrium in Heart Failure With Preserved
Ejection Fraction: Structure, Function, and Significance. Circ
Heart Fail 2014; 7:1042-1049.
- Ramrakha P, Hill J. Heart failure. In: Ramarka P and Hill J.
Oxford Handbook of Cardiology. 1th ed Oxford University Press;
2006. pp. 259-296.
- The Criteria Committee of the New York Heart Association.
Nomenclature and Criteria for Diagnosis of Diseases of the Heart
and Great Vessels. 9th ed Little, Brown & Co; Boston, Mass:
1994. pp. 253–256.
- Chawla SL, Herzog CA, Costanzo RM, Tumlin J, Kellum JA,
McCullough PA, Ronco C, ADQI XI. Workgroup. Proposal for a
Functional Classification System of Heart Failure in Patients
With End-Stage Renal Disease - Proceedings of the Acute Dialysis
Quality Initiative (ADQI) XI Workgroup. J Am Coll Cardiology
2014; 63: 1246-1252.
- Pecoits-Filho R, Barberato SH. Echocardiography in Chronic
Kidney Disease: Diagnostic and Prognostic Implications. Nephron
Clin Pract 2010; 114: c 242–c247.
- Kadappu KK, Thomas L. Tissue Doppler Imaging in
Echocardiography: Value and Limitations. Heart Lung Circ 2015;
24: 224–233.
- Galderisi M.Diastolic dysfunction and diastolic heart
failure: diagnostic, prognostic and therapeutic aspects.
Cardiovasc Ultrasound 2005; 3:9
- Dalen H, Thorstensen A, Vatten LJ, Aase SA, Stoylen A.
Reference Values and Distribution of Conventional
Echocardiographic Doppler Measures and Longitudinal Tissue
Doppler Velocities in a Population Free from Cardiovascular
Disease. Circ Cardiovasc Imaging 2010; 3 (5): 614-622.
- Chiu DY, Green D, Abidin N, Sinha S, Kalra PA.
Echocardiography in Hemodialysis Patients: Uses and Challenges.
Am J Kidney Dis 2014; 64 (5): 804-816.
- Nedeljković B, Miloradović V, Radovanović M, Nikolić A,
Poskurica M, Petrović D. Dijastolna srčana slabost kod bolesnika
na hemodijalizi: etiopatogeneza, dijagnostika i lečenje. Med Čas
2014; 48 (1): 21-27.
- Pecoits-Filho R, Bucharles S, Silvio H. Barberato. Diastolic
Heart Failure in Dialysis Patients: Mechanisms, Diagnostic
Approach, and Treatment. Seminars in Dialysis. 2012; 25: 35–41.
- Andreoli C, Parissis TJ. Biomarkers in Congestive Heart
Failure. In: Tousoulis D, Stefanadis C. Biomarkers in
Cardiovascular Diseases. 2013; pp 101-145.
- Toutousas K, Synteos A, Dracopoulou M. Cardiac Biomarkers in
Acute Coronary syndrome. In: Tousoulis D, Stefanadis C.
Biomarkers in Cardiovascular Diseases. 2013; pp. 87-100.
- Poskurica M, Petrović D, Lazarević T, Grubor M. Ishemijska
bolest srca. U: Poskurica M, Urednik, Ishemijska bolest srca kod
bolesnika sa završnim stadijumom hronične slabosti bubrega;
Zbornik predavanja sa KME 2007. Izdavač Medicinski fakultet
Kragujevac, ''Inter Print'', Kragujevac, 2007; pp. 1-27.
- Poskurica M, Poskurica M, Petrović D. Sekundarni
hiperparatireoidizam u hroničnoj bolesti bubrega –
etiopatogeneza, dijagnostika i lečenje. Vojnosanit Pregl 2016;
73 (4): 376–381.
- Lopez B, Querejeta R, Gonzalez A, Sanchez E, Larman M, Diez
J. Effects of loop diuretics on myocardial fibrosis and collagen
type I turnover in chronic heart failure. J Am Coll Cardiol
2004; 43: 2028-2035.
|
|
|
|





