| |
|
|
UVOD
Demencija je stanje koje podrazumeva značajno smanjenje
kognitivnih sposobnosti, uključujući i deficit pamćenja, promene
raspoloženja i probleme u komunikaciji i rasuđivanju [1]. Postala je
prioritet javnog zdravstva i socijalne zaštite širom sveta, s
obzirom da se broj pacijenata sa demencijom povećava uglavnom zbog
starenja stanovništva [2]. Demencija praćena gubitkom intelektualnih
sposobnosti, dovoljno teška da ometa radno ili socijalno
funkcionisanje, postala je glavni teret javnog zdravlja u SAD [3],
gde je prevalencija u 2012. godini bila 8,8% među populacijom od 65
i više godina [4].
Arterijska hipertenzija predstavlja jedan od glavnih faktora rizika
za nastanak demencija [5]. Kontrola krvnog pritiska u srednjem
životnom dobu može poboljšati zdravlje mozga i smanjiti rizik za
demenciju u starijem dobu [6].
Arterijska hipertenzija i hiperlipidemija ostvaruju mnogo sličnih
efekata na arterijski zid, a oksidativni stres, njihov zajednički
mehanizam, može aktivirati gene uključene u stvaranju inflamatornog
procesa, koji u prisustvu hiperlipidemije, dovodi do formiranja
aterosklerotičnog plaka [7]. Procenjuje se da jedan od pet
ishemijskih moždanih udara potiče od karotidnih plakova, uglavnom
usled arterio-arterijske embolizacije [8]. Ateroskleroza je među
najčešćim patološkim promenama u ishemijskoj kardiovaskularnoj i
cerebrovaskularnoj bolesti [9]. U studiji kohorte pacijenata nakon
lakunarnog moždanog udara, povezanih sa bolestima malih krvnih
sudova, 50% pacijenata je kasnije patilo od blagog kognitivnog
oštećenja ili demencije [10]. Procesi starenja u krvnim sudovima
povećavaju rizik za sistemske patofiziološke procese (ateroskleroza)
i rizik od cerebrovaskularnog oštećenja [11].
Vaskularni i neurodegenerativni poremećaji su česti kod starijih
osoba i mogu koegzistirati kod istog pacijenta [12].Ovi procesi u
osnovi demencije su međusobno potencirani u razvoju kognitivnog
oštećenja, dajući kliničke fenotipove i neuroimidžing koji se
preklapaju [13]. Mešovita demencija, Alchajmerova demencija i
vaskularna demencija su najčešći tipovi demencije [14]. Nekoliko
studija baziranih na autopsiji je prijavilo prevalenciju demencije
39%-44%, od čega 36%-50% odgovara Alchajmerovoj demenciji, 30%-43%
vaskularnoj demenciji, a 20%-22% mešovitoj demenciji [13].
Cilj ovog istraživanja bio je da ispita uticaj arterijske
hipertenzije na nastanak cerebralnih lezija kod pacijenata sa
demencijom kod kojih je postojao rizik za aterosklerozu usled
prisustva farmakološki netretirane hiperholesterolemije.
MATERIJAL I METODE
Retrospektivna opservaciona studija sprovedena je na uzorku
pacijenata u Domu zdravlja „Dr Simo Milošević” Čukarica u Beogradu.
Podaci za istraživanje dobijeni su iz zdravstvenih kartona
pacijenata kod kojih je prethodno od strane neurologa ili psihijatra
dijagnostikovana jedna od formi demencije prema MKB-10
kriterijumima.
Kriterijumi za uključivanje u studiju bili su: životna dob između 65
i 85 godina, prisutan kognitivni deficit u sklopu demencije, utvrđen
kliničkom kvalitativnom procenom, kao i primenom upitnika Mini
Mental State Examination (MMSE), cerebralne lezije verifikovane
nalazom neuroimidžinga, farmakološki netretirana
hiperholesterolemija, negativna lična anamneza o pušenju i odsustvo
dijabetes melitusa. Kriterijum za isključivanje bila je verifikovana
intrakranijalna hemoragija i atrijalna fibrilacija.
Pacijenti su podeljeni u tri grupe na osnovu nalaza neuroimidžinga,
kojim je ustanovljeno prisustvo samo cerebrovaskularnih ishemijskih
lezija (CVIL) ili cerebralnih neurodegenerativnih lezija (NDL) ili
njihova udruženost (MxL). Od neuroimidžing metoda radi dijagnostičke
obrade pacijenata na sekundarnom ili tercijarnom nivou zdravstvene
zaštite primenjivani su MDCT sken i/ili MRI endokranijuma,
transkranijalni dopler (TCD) krvnih sudova mozga i kolor dopler sken
(CDS) magistralnih arterija vrata. Pacijenti su dalje razvrstani na
one sa arterijskom hipertenzijom (HTAp) i one bez arterijske
hipertenzije (nonHTAp). Kod svih HTAp bila je primenjena
antihipertenzivna farmakoterapija. Kod pacijenata sa CVIL isključeni
su atrijalna fibrilacija, tromboza leve srčane komore i
aterosklerotski plak aorte kao uzrok nastanka tromboembolije i
posledične ishemijske lezije mozga.
U istraživanju je postavljena radna hipoteza da između vrste
cerebralnih lezija i arterijske hipertenzije ne postoji povezanost,
tj. da ne postoji statistički značajna razlika učestalosti
arterijske hipertenzije između definisanih grupa pacijenata sa
određenim patoanatomskim lezijama, te da razlika u udelu muškaraca i
žena u odnosu na hipertenziju nije statistički značajna ni u jednoj
od definisanih grupa patoanatomskih lezija.
Za obradu podataka korišćen je statistički softver Statistica 13.2.
U cilju statističke deskripcije primenjene su mere centralne
tendencije, a u cilju statističke analize primenjen je Hi-kvadrat
test radi ispitivanja signifikantnosti razlike učestalosti
posmatranih varijabli.
REZULTATI
U studiju je uključeno ukupno 72 pacijenta, od čega 37 muškaraca
(51%) i 35 žena (49%). Prema nalazu neuroimidžinga prisustvo
cerebrovaskularnih ishemijskih lezija verifikovano je kod 25
pacijenata (35%), cerebralnih neurodegenerativnih lezija kod 28
pacijenata (39%), dok su mešovite lezije bile prisutne kod 19
pacijenata (26%). Arterijsku hipertenziju imalo je 45 pacijenata
(63%), koja je kod 36 (80%) bila regulisana antihipertenzivnom
terapijom.
Tabela 1. Vrednosti krvnog pritiska po grupama prema
klasifikaciji Evropskog udruženja za kardiologiju
Table 1. Values of blood pressure by groups according to the
classification of the European Society of Cardiology
| Krvni pritisak |
Broj pacijenata |
Sistolni krvni pritisak
x̅ ± sd |
Dijastolni krvni pritisak
x̅ ± sd |
| Optimalan |
3 |
108,33 ± 7,64 |
68,33 ± 2,89 |
| Normalan |
7 |
123,57 ± 2,44 |
80,00 ± 0,00 |
| Visok normalan |
17 |
131,76 ± 2,46 |
85,00 ± 0,00 |
| Stadijum I hipertenzije |
21 |
147,14 ± 6,04 |
92,62 ± 2,56 |
| Stadijum II hipertenzije |
20 |
165,00 ± 4,87 |
102,00 ± 2,51 |
| Stadijum III hipertenzije |
4 |
190,00 ± 10,80 |
115,00 ± 4,08 |
| Ukupno |
72 |
146,94 ± 19,83 |
92,43 ± 10,58 |
Legenda: x̅ - srednja vrednost, sd - standardna devijacija.
Legend: x̅ - mean, sd - standard deviation.
Na osnovu značajnosti razlike učestalosti arterijske hipertenzije u
definisanim grupama pacijenata sa određenim patoanatomskim lezijama
utvrđeno je da ona nije statistički značajna između grupa sa
cerebrovaskularnim ishemijskim i mešovitim lezijama, ali da je
značajna između grupa pacijenata sa cerebrovaskularnim ishemijskim i
cerebralnim neurodegenerativnim lezijama (p<0,01), kao i između
grupa sa cerebralnim neurodegenerativnim i mešovitim lezijama
(p<0,01). Razlika u udelu muškaraca i žena u odnosu na hipertenziju,
posmatrano po definisanim grupama patoanatomskih lezija, nije
statistički značajna u grupi CVIL i MxL (p>0,01), ali jeste
statistički značajna u grupi NDL(p<0,01), gde značajno veći udeo
imaju muškarci.
Tabela 2. Distribucija ispitanika u odnosu na arterijsku
hipertenziju prema vrsti cerebralnih lezija i polu
Table 2. Distribution of subjects in relation to arterial
hypertension by type of cerebral lesions and gender
| cerebral lesion type |
HTAp |
nonHTAp |
Σ |
| m |
f |
(m+f)1 |
m |
f |
(m+f)2 |
(m+f)1+(m+f)2 |
| CVIL |
9 |
11 |
20 |
2 |
3 |
5 |
25 |
| NDL |
8 |
2 |
10 |
11 |
7 |
18 |
28 |
| MxL |
6 |
9 |
15 |
1 |
3 |
4 |
19 |
| Σ |
23 |
22 |
45 |
14 |
13 |
27 |
72 |
Legenda: HTAp - pacijenti sa arterijskom hipertenzijom, nonHTAp -
pacijenti bez arterijske hipertenzije,
m - muškarci, f - žene, CVIL - cerebrovaskularne ishemijske lezije,
NDL - neurdegenerativne lezije,
MxL - mešovite lezije.
Legend: HTAp - patients with arterial hypertension, nonHTAp -
patients with no arterial hypertension,
m- male, f - female, CVIL - cerebrovascular ischemic lesions, NDL -
neuronegenerative lesions,
MxL - mixed lesions.
Ako se ispituje veza između dveju varijabli, vrste cerebralnih
lezija (CVIL, NDL, Mx) i arterijske hipertenzije (HTAp, nonHTAp) na
celom uzorku, empirijska vrednost Hi-kvadrat testa iznosi 14,03 pa
visoko statistički značajno postoji zavisnost izmedju ove dve
varijable (p<0,01). Ispitivanjem povezanosti između ovih dveju
varijabli posebno za muškarce i posebno za žene, empirijske
vrednosti Hi-kvadrat testa iznose redom 4,38 i 2,05 i ne postoji
statistički značajna razlika. U ispitivanju razlike između udela
HTAp sa CVIL (80%) i MxL (78,95%) za celi uzorak, p-vrednost iznosi
93,17% te se može zaključiti da ne postoji statistički značajna
razlika između ovih udela (p>0,01). Međutim, u ispitivanju razlike
između udela HTAp sa CVIL (80%) ili MxL (78,95%) za celi uzorak te
udela NDL (35,71%), p-vrednost iznosi 0,36% pa se tada može
zaključiti da postoji visoko statistički značajna razlika između
ovih udela (p<0,01).
Ispitivanjem razlike između udela HTAp za CVIL između muškaraca
(39,13%) i žena (50%), p-vrednost iznosi 46,32% te se prihvata
pretpostavka da ne postoji statistički značajna razlika u udelima
muškaraca i žena (p>0,05). Ispitivanjem razlike između udela HTAp za
MxL između muškaraca (26,08%%) i žena (40,91%), p-vrednost iznosi
29,17% i ne nalazi se statistički zančajna razlika u udelima
muškaraca i žena. Međutim, ispitivanjem razlike između udela HTAp za
NDL između muškaraca (34,78%) i žena (9,09%), p-vrednost iznosi
3,82% te postoji statistički značajna razlika (p<0,01), pri čemu
muškarci imaju veći udeo. Kod nonHTAp statistički značajne razlike
između muškaraca i žena po pojedinim vrstama CVIL, NDL i MxL ne
postoje, verovatno usled malog uzorka.
Grafikon 1.Učestalost vrsta cerebralnih
lezija u odnosu na arterijsku hipertenziju
Chart 1. Frequency ofcerebral lesions types in relation to
arterial hypertension
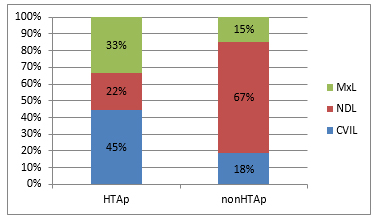
Legenda: HTAp - pacijenti sa arterijskom hipertenzijom, nonHTAp -
pacijenti bez arterijske hipertenzije, CVIL - cerebrovaskularne
ishemijske lezije, NDL - neurdegenerativne lezije, MxL - mešovite
lezije.
Legend: HTAp - patients with arterial hypertension, nonHTAp -
patients with no arterial hypertension, CVIL - cerebrovascular
ischemic lesions, NDL - neuronegenerative lesions, MxL - mixed
lesions.
DISKUSIJA
Prevencija, identifikacija i smanjenje rizika od demencije, kao i
pružanje kvaliteta nege osobama sa demencijom izdvojeni su od strane
Svetske zdravstvene organizacije među deset glavnih istraživačkih
prioriteta za smanjenje globalnog opterećenja demencijom do 2025.
godine [15]. Glavni promenljivi faktori rizika za kognitivno
oštećenje i demenciju odnose se ili utiču na vaskularni sistem,
uključujući hipertenziju, pušenje, gojaznost, dijabetes,
hiperholesterolemiju i nedostatak fizičkog vežbanja [16].
Kardiovaskularne bolesti i faktori rizika, kao što su hipertenzija i
dijabetes melitus, identifikovani su kao determinante mortaliteta,
ali samo u studijama starijih pacijenata sa demencijom [17].
Hipertenzija povećava aterosklerotski rizik i predstavlja glavni
faktor rizika za srčani udar i ishemijski moždani udar putem prekida
normalnog toka krvi [18]. Pored toga, visok krvni pritisak je
primarni faktor rizika za hemoragijski moždani udar usled povećane
vaskularne osetljivosti na rupture u mozgu [19]. Aproksimativno, 87%
moždanih udara su ishemijski [20]. Hipertenzija je jedan od vodećih
uzroka morbiditeta i mortaliteta bez obzira na vrstu moždanog udara
[21]. Hipertenzija je identifikovana kao jedan od najznačajnijih
promenljivih faktora rizika za moždani udar i može rezultirati
vaskularnom demencijom [22]. Cerebralna autoregulacija je često
oštećena kod hipertoničara i starijih osoba i doprinosi razvoju
moždanog udara, vaskularnog kognitivnog poremećaja i vaskularne
demencije [23].
Arterijska hipertenzija, takođe, pospešuje kapilarno proređivanje,
posebno u dubokoj beloj masi hemisfera i bazalnim ganglijama,
povezana je sa infiltracijom perivaskularnih makrofaga, povećanim
oksidativnim stresom, endotelijalnom disfunkcijom i kompromitovanom
funkcionalnom hiperemijom, a ove promene pospešuju formiranje malih
lakunarnih infarkta, asimptomatskih lezija bele mase, mikroinfarkta
i mikrokrvarenja, što je sve u korelaciji sa padom kognitivne
funkcije kod pacijenata sa vaskularnom i Alchajmerovom demencijom
[23].
Kada je reč o uticaju hipertenzije na kognitivne funkcije, u
literaturi se mogu naći različiti podaci. Jedna studija je utvrdila
oštećenje dugotrajne memorije i izvršnog funkcionisanja u
hipertenzivnim slučajevima, u drugoj studiji utvrđeno je da je
hipertenzija bila povezana sa funkcionisanjem memorije samo kod
muškaraca, u trećoj studiji nisu utvrđene kognitivne razlike kada su
upoređivane nehipertenzivne i medikamentima tretirane hipertenzivne
grupe i na kraju, u četvrtoj studiji, longitudinalni dokazi
sugerisali su povezanost između hipertenzije i kognitivnog pada u
srednjem, ali ne i u kasnom životnom dobu [24]. U studiji koja se
bavila ispitivanjem povezanosti promenljivih faktora rizika sa
Alchajmerovom bolešću korišćenjem genetičkih varijanti nije nađena
povezanost između vrednosti sistolnog krvnog pritiska i Alchajmerove
bolesti [25]. Efekti antihipertenzivne terapije na kognitivnu
funkciju u kontrolisanim studijama bili su oprečni, a meta-analize
studija nisu dale jasne dokaze da li antihipertenzivna terapija
smanjuje incidenciju demencija [26].
Uticaj holesterola na nastanak demencija i značaj terapije statinima
u njihovoj prevenciji bili su predmet mnogih istraživanja. U
studijama koje su analizirale efekat holesterola na demencije,
navodi se da su kod vaskularne demencije, kako visok nivo
LDL-holesterola, tako i nizak nivo HDL-holesterola poznati faktori
rizika za aterosklerozu karotidnih i moždanih arterija, što može
rezultirati kognitivnim oštećenjem zbog cerebralne hipoperfuzije ili
embolizma. Kod Alchajmerove demencije postoje oprečni epidemiološki
podaci, gde po nekima povišen nivo serumskog holesterola povećava
rizik za njen razvoj, dok u drugima nema efekta ili postoji
negativna povzanost [27]. Dosadašnji dokazi ukazuju da statini dati
u poznijem životnom dobu nemaju efekta u prevenciji kognitivnog pada
i demencije [28], dok vodič Američkog udruženja za srce sugeriše da
lečenje hiperholesterolemije u prevenciji demencije ima nesigurnu
korist [29]. Mi smo se opredelili da u studiju uključimo samo
pacijente kod kojih je verifikovana hiperholesterolemija, bez
primene hipolipemijskih medikamenata u bilo kom prethodnom periodu.
U našoj studiji klasifikacija cerebralnih lezija, cerebrovaskularne
ishemijske, neurodegenerativne i mešovite bazirana je na nalazu
neuroimidžinga. Neuroimidžing povećava tačnost dijagnoze za
različite podtipove demencije [30]. Multimodalnost neuroimidžing
podataka, kao što su MRI i PET pružaju dragocene uvide u
abnormalnosti [31]. MRI je korišćena u nekoliko studija za
strukturnu i funkcionalnu karakterizaciju neuroloških poremećaja u
celom mozgu [32]. Intenzitet i stadijum neurodegeneracije mogu se
identifikovati pomoću atrofije merene strukturnom MRI [33].U studiji
koja je ispitivala incidencu demencija u posmatranoj populaciji
korišćene su neuroimidžing metode, magnetna rezonanca i
kompjuterizovana tomografija, samostalno ili u kombinaciji [34].
Tokom desetogodišnjeg praćenja, od 1562 ispitanika životne dobi 60 i
više godina, 358 je razvilo demenciju, od čega je 238 ispitanika
doživelo Alchajmerovu demenciju, 93 vaskularnu demenciju, a 43 druge
tipove demencije, pri čemu je od ispitnaika 21 sa Alchajmerovom
demencijom i 22 sa vaskularnom demencijom imalo druge
koegzistirajuće tipove demencije, od kojih je 16 bilo sa mešovitim
tipom Alchajmerove i vaskularne demencije [34].
Hemoragijski moždani udari karakterišu se većim volumenom lezije i
višim intrakranijalnim pritiskom, uopšteno se ispoljavaju težim
oštećenjem mozga i zahvataju različite regije mozga u odnosu na
ishemijske moždane udare [35]. Pored toga, strategije lečenja posle
intrakranijalne hemoragije i subarahnoidalne hemoragije mogu
doprineti manjem kapacitetu oporavka tkiva mozga [36]. Zbog većih
posledica i neophodnosti složenijeg sagledavanja, pacijenti sa
demencijom nakon hemoragijskih lezija mozga nisu obuhvaćeni našim
istraživanjem.
Kako bi se isključio uticaj hiperglikemije kod pacijenata obolelih
od dijabetes melitusa i nikotina kod pušača, ovi pacijenti nisu
uključivani u istraživanje. Dokazano je da vaskularni faktori
rizika, kao što su hipertenzija, dislipidemija i dijabetes, igraju
važnu ulogu u razvoju umerenog kognitivnog oštećenja, demencije i
Alchajmerove bolesti. [37] Mnoge studije su pokazale da osobe sa
dijabetes melitusom imaju veći rizik od demencije i kognitivne
disfunkcije [38], a hiperglikemija je uključena u mehanizme
kognitivne disfunkcije povezane sa dijabetes melitusom [39].
Dugotrajna supklinička hiperglikemija predstavlja faktor rizika za
umereno kognitivno oštećenje u starijih osoba [40]. Povišen odnos
glikoziliranog albumina i hemoglobina A1c značajno je povezan sa
rizikom od Alchajmerove demencije [41]. Pušači u poređenju sa
nepušačima imaju veći stepen atrofije mozga i manju gustinu sive
mase [42], a nivo plazma kotinina, metabolita nikotina, upravno
proporcionalno je povezan sa rizikom od demencije [43].
ZAKLJUČAK
U ovom istraživanju potvrđeno je da arterijska hipertenzija
predstavlja značajan faktor rizika za nastanak cerebrovaskularnih
ishemijskih, ali ne i cerebralnih neurodegenerativnih lezija koje
dovode do kognitivnog deficita kod pacijenata sa demencijom i
rizikom za aterosklerozu uz prisustvo farmakološki netretirane
hiperholesterolemije, nezavisno od pola.
Prisustvo cerebrovaskularnih ishemijskih lezija verifikovano je kod
25 pacijenata (35%), cerebralnih neurodegenerativnih lezija kod 28
pacijenata (39%), dok su mešovite lezije bile prisutne kod 19
pacijenata (26%). Na osnovu značajnosti razlike učestalosti
arterijske hipertenzije u definisanim grupama pacijenata sa
određenim patoanatomskim lezijama utvrđeno je da ona nije
statistički značajna između grupa sa cerebrovaskularnim ishemijskim
i mešovitim lezijama, ali da je visoko značajna između grupa
pacijenata sa cerebrovaskularnim ishemijskim i cerebralnim
neurodegenerativnim lezijama (p<0,01), kao i između grupa sa
cerebralnim neurodegenerativnim i mešovitim lezijama (p<0,01). Ova
studija doprinosi boljem razumevanju uticaja promenljivih faktora
rizika, kao što je arterijska hipertenzija, ali i dislipidemija, na
nastanak demencija, i ukazuje na značaj redukcije njihovog
nepovoljnog uticaja u predisponiranih pacijenata, te nephodnost
njihove blagovremene i adekvatne dijagnostike i lečenja. Imajući u
vidu da približno 50-80% osoba sa demencijom ne dobija pravovremeno
dijagnozu demencije, a 45-55% osoba sa dijagnozom demencije dobija
dijagnozu nespecifične demencije u primarnoj zdravstvenoj zaštiti,
ova studija doprinosi adekvatnijem pristupu u dijagnostičkoj
evaluaciji pacijenata sa demencijom.
LITERATURA
- Hung CM, Li YC, Chen HJ, Lu K, Liang CL, Liliang PC, et al.
Risk of dementia in patients with primary insomnia: a nationwide
population-based case-control study. BMC Psychiatry.
2018;18(1):38. Available from:
https://bmcpsychiatry.biomedcentral.com/articles/10.1186/s12888-018-1623-0
- Ohara T, Oishi E, Ninomiya T. Day-to-day blood pressure
variability and dementia. Oncotarget. 2017;8(70):114416-7.
- Wei J, Hu Y, Zhang L, Hao Q, Yang R, Lu H, et al. Hearing
Impairment, Mild Cognitive Impairment, and Dementia: A
Meta-Analysis of Cohort Studies. Dement Geriatr Cogn Dis Extra.
2017;7(3):440-52.
- Langa KM, Larson EB, Crimmins EM, Faul JD, Levine DA, Kabeto
MU, et al. A comparison of the prevalence of dementia in the
United States in 2000 and 2012. JAMA Intern Med.
2017;177(1):51-8.
- Launer LJ, Ross GW, Petrovitch H, Masaki K, Foley D, White
LR, et al. Midlife blood pressure and dementia: the
Honolulu-Asia aging study. Neurobiol Aging. 2000;21(1):49-55.
- Sabayan B, Sorond F. Reducing Risk of Dementia in Older Age.
JAMA. 2017;317(19):2028.
- Alexander RW. Hypertension and the pathogenesis of
atherosclerosis. Oxidative stress and the mediation of arterial
inflammatory response: a new perspective. Hypertension.
1995;25(2):155-61.
- Moroni F, Magnoni M, Vergani V, Ammirati E, Camici PG.
Fractal analysis of plaque border, a novel method for the
quantification of atherosclerotic plaque contour irregularity,
is associated with pro-atherogenic plasma lipid profile in
subjects with non-obstructive carotid stenoses. PLoS One.
2018;13(2). Available from:
http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0192600
- Lv JX, Kong Q, Ma X. Current advances in circulating
inflammatory biomarkers in atherosclerosis and related
cardio-cerebrovascular diseases. Chronic Dis Transl Med.
2017;3(4):207-12.
- Jacova, C., Pearce, L. A., Costello, R., McClure, L. A.,
Holliday, S. L., Hart, R. G., et al. Cognitive impairment in
lacunar strokes: the SPS3 trial. Ann. Neurol. 2012;72(3):351-62.
- Jaul E, Meiron O. Systemic and Disease-Specific Risk Factors
in Vascular Dementia: Diagnosis and Prevention. Front Aging
Neurosci. 2017;9:333. Available from:
https://www.frontiersin.org/articles/10.3389/fnagi.2017.00333/full
- Gorelick PB, Scuteri A, Black SE, Decarli C, Greenberg SM,
Iadecola C, et al. Vascular contributions to cognitive
impairment and dementia: a statement for healthcare
professionals from the american heart association/american
stroke association. Stroke. 2011;42(9):2672-713.
- Custodio N, Montesinos R, Lira D, Herrera-Pérez E, Bardales
Y, Valeriano-Lorenzo L. Mixed dementia: A review of the
evidence. Dement Neuropsychol. 2017;11(4):364-70.
- Chui HC, Ramirez-Gomez L. Clinical and imaging features of
mixed Alzheimer and vascular pathologies. Alzheimers Res Ther.
2015;7:21. Available from:
https://alzres.biomedcentral.com/articles/10.1186/s13195-015-0104-7
- Shah H, Albanese E, Duggan C, Rudan I, Langa KM, Carrillo
MC, et al. Research priorities to reduce the global burden of
dementia by 2025. Lancet Neurol. 2016;15(12):1285-94.
- Deckers K, Schievink SHJ, Rodriquez MMF, van Oostenbrugge
RJ, van Boxtel MPJ, Verhey FRJ, et al. Coronary heart disease
and risk for cognitive impairment or dementia: Systematic review
and meta-analysis. PLoS One. 2017;12(9). Available from:
http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0184244
- Rhodius-Meester HFM, Liedes H, Koene T, Lemstra AW,
Teunissen CE, Barkhof F, et al. Disease-related determinants are
associated with mortality in dementia due to Alzheimer's
disease. Alzheimers Res Ther. 2018;10(1):23. Available from:
https://alzres.biomedcentral.com/articles/10.1186/s13195-018-0348-0
- Soler EP, Ruiz VC. Epidemiology and risk factors of cerebral
ischemia and ischemic heart diseases: similarities and
differences. Curr Cardiol Rev. 2010;6(3):138-49.
- Kim HC, Nam CM, Jee SH, Suh I. Comparison of blood
pressure-associated risk of intracerebral hemorrhage and
subarachnoid hemorrhage: Korea Medical Insurance Corporation
study. Hypertension. 2005;46(2):393-7.
- Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, et
al. Heart disease and stroke statistics-2015 update: a report
from the American Heart Association. Circulation.
2015;131:29–322.
- Mullen MT, McKinney JS, Kasner SE. Blood pressure management
in acute stroke. J Hum Hypertens. 2009;23:559–69.
- Singh M, Raj D, Raina SK, Gandhi MK, Chander V. Using
Multistate Observational Studies to Determine Role of
Hypertension and Diabetes as Risk Factors for Dementia. J
Neurosci Rural Pract. 2016;7(5):3-6.
- Shekhar S, Liu R, Travis OK, Roman RJ, Fan F. Cerebral
Autoregulation in Hypertension and Ischemic Stroke: A Mini
Review. J Pharm Sci Exp Pharmacol. 2017;2017(1):21-7.
- Stephan BCM, Minett T, Muniz-Terrera G, Harrison SL,
Matthews FE, Brayne C. Neuropsychological profiles of vascular
disease and risk of dementia: implications for defining vascular
cognitive impairment no dementia (VCI-ND). Age Ageing.
2017;46(5):755-60.
- Larsson SC, Traylor M, Malik R, Dichgans M, Burgess S,
Markus HS. Modifiable pathways in Alzheimer's disease: Mendelian
randomisation analysis. BMJ. 2017;359:5375. Available from:
http://www.bmj.com/content/359/bmj.j5375
- Peters R, Beckett N, Forette F, Tuomilehto J, Clarke R,
Ritchie C, et al. Incident dementia and blood pressure lowering
in the Hypertension in the Very Elderly Trial cognitive function
assessment (HYVET-COG): a double-blind, placebo controlled
trial. Lancet Neurol. 2008;7(8):683-9.
- Appleton JP, Scutt P, Sprigg N, Bath PM.
Hypercholesterolaemia and vascular dementia. Clin Sci (Lond).
2017;131(14):1561-78.
- McGuinness B, Craig D, Bullock R, Passmore P. Statins for
the prevention of dementia. Cochrane Database Syst Rev.
2016;1:003160. Available from:
http://cochranelibrary-wiley.com/wol1/doi/10.1002/14651858.CD003160.pub3/full
- Gorelick PB, Scuteri A, Black SE, Decarli C, Greenberg SM,
Iadecola C, et al. Vascular contributions to cognitive
impairment and dementia: a statement for healthcare
professionals from the american heart association/american
stroke association. Stroke. 2011;42(9):2672-713.
- Staffaroni AM, Elahi FM, McDermott D, Marton K, Karageorgiou
E, Sacco S, et al. Neuroimaging in Dementia. Semin Neurol.
2017;37(5):510-37.
- Zhou T, Thung KH, Zhu X, Shen D. Feature Learning and Fusion
of Multimodality Neuroimaging and Genetic Data for Multi-status
Dementia Diagnosis. Mach Learn Med Imaging. 2017;10541:132-40.
- Lama RK, Gwak J, Park JS, Lee SW. Diagnosis of Alzheimer's
Disease Based on Structural MRI Images Using a Regularized
Extreme Learning Machine and PCA Features. J Healthc Eng.
2017;2017:5485080. Available from:
https://www.hindawi.com/journals/jhe/2017/5485080/.
- Lee W, Park B, Han K. Classification of diffusion tensor
images for the early detection of Alzheimer's disease. Comput
Biol Med. 2013;43(10):1313-20.
- Takae K, Hata J, Ohara T, Yoshida D, Shibata M, Mukai N, et
al. Albuminuria Increases the Risks for Both Alzheimer Disease
and Vascular Dementia in Community-Dwelling Japanese Elderly:
The Hisayama Study. J Am Heart Assoc. 2018;7(2). Available from:
http://jaha.ahajournals.org/content/7/2/e006693
- Corraini P, Henderson VW, Ording AG, Pedersen L,
Horváth-Puhó E, Sørensen HT. Long-Term Risk of Dementia Among
Survivors of Ischemic or Hemorrhagic Stroke. Stroke.
2017;48(1):180-6.
- Van Dijk BJ, Vergouwen MD, Kelfkens MM, Rinkel GJ, Hol EM.
Glial cell response after aneurysmal subarachnoid hemorrhage -
Functional consequences and clinical implications. Biochim
Biophys Acta. 2016;1862(3):492-505.
- Ricci G, Pirillo I, Tomassoni D, Sirignano A, Grappasonni I.
Metabolic syndrome, hypertension, and nervous system injury:
Epidemiological correlates. Clin Exp Hypertens. 2017;39(1):8-16.
- Umegaki H, Makino T, Uemura K, Shimada H, Hayashi T, Cheng
XW, et al. The Associations among Insulin Resistance,
Hyperglycemia, Physical Performance, Diabetes Mellitus, and
Cognitive Function in Relatively Healthy Older Adults with
Subtle Cognitive Dysfunction. Front Aging Neurosci. 2017;9:72.
Available from:
https://www.frontiersin.org/articles/10.3389/fnagi.2017.00072/full
- Geijselaers SLC, Sep SJS, Stehouwer CDA, Biessels GJ.
Glucose regulation, cognition, and brain MRI in type 2 diabetes:
a systematic review. Lancet Diabetes Endocrinol.
2015;3(1):75-89.
- Wang F, Zhao M, Han Z, Li D, Zhang S, Zhang Y, et al.
Long-Term Subclinical Hyperglycemia and Hypoglycemia as
Independent Risk Factors for Mild Cognitive Impairment in
Elderly People. Tohoku J Exp Med. 2017;242(2):121-8.
- Mukai N, Ohara T, Hata J, Hirakawa Y, Yoshida D, Kishimoto
H, Koga M, Nakamura U, Kitazono T, Kiyohara Y, Ninomiya T.
Alternative Measures of Hyperglycemia and Risk of Alzheimer's
Disease in the Community: The Hisayama Study. J Clin Endocrinol
Metab. 2017;102(8):3002-10.
- Durazzo TC, Mattsson N, Weiner MW; Alzheimer's Disease
Neuroimaging Initiative. Smoking and increased Alzheimer's
disease risk: a review of potential mechanisms. Alzheimers
Dement. 2014;10(3):122-45.
- Batty GD, Shipley MJ, Kvaavik E, Russ T, Hamer M, Stamatakis
E, Kivimaki M. Biomarker assessment of tobacco smoking exposure
and risk of dementia death: pooling of individual participant
data from 14 cohort studies. J Epidemiol Community Health.
2018.Available from:
http://jech.bmj.com/content/early/2018/01/24/jech-2017-209922.full
|
|
|
|

